Перейти к:
Прорыв гематоэнцефалического барьера после острой гипоксии головного мозга у детей
https://doi.org/10.17749/2949-5873/rehabil.2024.13
Аннотация
Актуальность. Поражение нейронов, в т.ч. при гипоксически-ишемическом повреждении центральной нервной системы (ЦНС) в перинатальном периоде, приводит к выбросу нейронспецифической енолазы (НСЕ) в периферический кровоток. НСЕ можно рассматривать как биологический маркер нарушений нервной системы и на основе анализа ее уровня осуществлять своевременную реабилитационную поддержку новорожденным, тем самым снижая вероятность развития осложнений, связанных с повреждением ЦНС.
Цель: ретроспективно оценить изменения содержания НСЕ в периферической крови на протяжении 24 нед у детей различного гестационного возраста, перенесших перинатальное гипоксически-ишемическое поражение ЦНС.
Материал и методы. В исследование включены 49 детей, перенесших перинатальное гипоксически-ишемическое повреждение ЦНС. Сроки беременности составили от 32 до 41 нед. Контрольная группа состояла из 28 здоровых доношенных младенцев. Измерение уровней НСЕ проводили с помощью иммуноферментного анализа. Пациенты основной группы были дополнительно разделены на подгруппы в зависимости от оценок по шкале Апгар на 1-й минуте после рождения, гестационного возраста, а также преимущественного поражения ЦНС – геморрагического с внутрижелудочковыми кровоизлияниями или ишемического с перивентрикулярными лейкомаляциями.
Результаты. На протяжении всего периода наблюдения концентрации НСЕ обратно коррелировали с оценками по шкале Апгар, при этом более низкие показатели по шкале Апгар были связаны с более высокими уровнями НСЕ. Кроме того, в подгруппе со сроком беременности 32–33 нед отмечены значительно более высокие значения НСЕ по сравнению с подгруппами со сроками беременности 34–36 и 37–41 нед, а также с контрольной группой. Уровень НСЕ у пациентов с перивентрикулярными лейкомаляциями был стабильно ниже, чем у детей с внутрижелудочковыми кровоизлияниями, начиная с 1-й недели. Примечательно, что на 4-й неделе наблюдалось отсроченное повышение концентрации НСЕ в сыворотке.
Заключение. Полученные данные свидетельствуют о том, что проницаемость гематоэнцефалического барьера для НСЕ сохраняется при перинатальном гипоксически-ишемическом повреждении ЦНС. Измерение концентрации НСЕ в сыворотке крови может служить ценным инструментом в клинической практике для анализа эффективности терапии на этапах лечения и реабилитации.
Ключевые слова
Для цитирования:
Александров А.Г., Блинов Д.В. Прорыв гематоэнцефалического барьера после острой гипоксии головного мозга у детей. Реабилитология. 2024;2(1):107-114. https://doi.org/10.17749/2949-5873/rehabil.2024.13
For citation:
Aleksandrov A.G., Blinov D.V. Blood-brain barrier breach after acute cerebral hypoxia in infants. Journal of Medical Rehabilitation. 2024;2(1):107-114. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.13
ВВЕДЕНИЕ / INTRODUCTION
Гематоэнцефалический барьер (ГЭБ) – это физиологический барьер, отделяющий кровоток от центральной нервной системы (ЦНС). Он состоит из эндотелиальных клеток, астроцитов и перицитов, которые составляют структурную основу ГЭБ. Взаимосвязанные эндотелиальные клетки в сосудах головного мозга имеют решающее значение для основной функции ГЭБ – поддержания гомеостаза мозга и защиты нервной ткани от циркулирующих токсинов, микроорганизмов и факторов иммунной системы, которые могут воспринимать ткань мозга как чужеродную [1][2].
К потенциальным исходам перинатального гипоксическиишемического поражения ЦНС относятся такие состояния, как гидроцефалия, микроцефалия, детский церебральный паралич, эпилепсия, задержка психомоторного развития. Однако определение тяжести и прогноза данных последствий связано с методологическими проблемами. Нарушение ГЭБ является значимым фактором развития многих неврологических нарушений и может способствовать хронизации патологических процессов при отсутствии своевременной реабилитационной поддержки [3–5]. Но факторы, приводящие к такой хронизации нейродегенеративных процессов, еще до конца не изучены. Поэтому состояние ГЭБ при гипоксически-ишемическом поражении ЦНС остается предметом постоянных научных исследований. Одним из таких «барьерных» антигенов является нейронспецифическая енолаза (НСЕ), которая обнаруживается в большинстве нейронов.
Фермент НСЕ, участвующий в гликолизе, существует в виде различных димерных изоферментов (αα, αβ, αγ, ββ и γγ), состоящих из субъединиц α, β и γ [6][7]. Обширные исследования НСЕ проводились в 1970–80-х гг., в результате чего было получено множество экспериментальных и клинических данных по ее анализу в биологических жидкостях при различных патологических состояниях [8–10]. В настоящее время НСЕ является единственным известным универсальным маркером дифференцированных нейронов и классифицируется как внутриклеточный фермент ЦНС. Качественная и количественная оценка НСЕ в сыворотке крови может дать ценную информацию о степени повреждения нейронов и нарушения ГЭБ при заболеваниях с непосредственным поражением нервной ткани [11]. Кроме того, исследования показывают, что активность НСЕ выше, когда патологический процесс затрагивает мембраны головного мозга, по сравнению с повреждением, ограниченным паренхимой головного мозга. Эти результаты подтверждают, что НСЕ является специфическим маркером повреждения нервной системы, особенно при гипоксии.
Поражение нейронов, в т.ч. при гипоксически-ишемическом поражении ЦНС, приводит к выбросу НСЕ в периферический кровоток. Поэтому НСЕ можно рассматривать как биологический маркер поражения нервной системы. По данным исследований, нарушение проницаемости ГЭБ может привести к отсроченной гибели нейронов и повреждению глиальных клеток даже после прекращения первоначального патологического воздействия, в частности гипоксии [12][13]. Кроме того, трофическая функция ГЭБ играет роль в определении размеров зоны гипоксически-ишемического повреждения [14]. Другим фактором, способствующим расширению этих зон и хронизации нейродегенеративных процессов, является проникновение «забарьерных» антигенов в периферический кровоток через поврежденный ГЭБ, что затем запускает механизмы иммунного ответа [15].
В исследованиях изучались особенности динамики уровня НСЕ в периферическом кровотоке у детей с перинатальным гипоксически-ишемическим поражением ЦНС в течение первых 24 нед жизни. Эти работы подтвердили статистически значимое увеличение концетрации НСЕ в 1-ю и 4-ю недели после рождения [16]. Однако данные ранее не были стратифицированы по гестационному возрасту. Хотя существует некоторая информация о различиях сывороточных концентрациях нейроспецифических белков у недоношенных детей разного гестационного возраста по сравнению с контрольной группой в течение первых 3 нед после рождения, сведения об отдаленной динамике концентрации НСЕ пока ограничены [17]. Поэтому публикация результатов анализа первичных данных, полученных в ходе клинических исследований, имеет ценность как с научной, так и с практической точки зрения.
Цель – ретроспективно оценить изменения содержания НСЕ в периферической крови на протяжении 24 нед у детей различного гестационного возраста, перенесших перинатальное гипоксически-ишемическое поражение ЦНС.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Дизайн исследования / Study design
В исследовании приняли участие 77 детей.В контрольную группу включены 28 здоровых доношенных детей, рожденных от здоровых матерей с нормально протекавшими беременностью и родами. Гестационный возраст варьировался от 38 до 41 нед. В основную группу (с перинатальным гипоксически-ишемическим поражением ЦНС) вошли 49 новорожденных, сроки беременности составили от 32 до 41 нед.
По шкале Апгар 49 детей с перинатальным гипоксически-ишемическим повреждением были разделены на три подгруппы: 23 новорожденных с оценкой по шкале Апгар 1–3 на 1-й минуте после рождения (подгруппа А1–3), 18 с оценкой 4–6 баллов (подгруппа А4–6) и 8 с оценкой 7–9 баллов (подгруппа А7–9).
Также пациенты были разделены на категории по массе тела и гестационному возрасту (ГВ), в результате чего было выделено три подгруппы: 12 детей со сроком беременности 32–33 нед (подгруппа ГВ32–33), 15 со сроком беременности 34–36 нед (подгруппа ГВ34–36) и 22 со сроком беременности 38–40 нед (подгруппа ГВ38–40).
На основании результатов нейросонографии были сформированы еще две подгруппы: с преимущественно геморрагическим поражением ЦНС с внутрижелудочковыми кровоизлияниями (подгруппа ВЖК, n=14) и с преимущественно ишемическим поражением с перивентрикулярными лейкомаляциями (подгруппа ПВЛ, n=7).
Методы обследования / Examination methods
Всем новорожденным проводили клинический осмотр с последующим присвоением баллов по шкале Апгар. Оценку внутренних структур головного мозга осуществляли методом нейросонографии. Тяжесть перинатального гипоксически-ишемического поражения ЦНС определяли согласно классификации перинатальных поражений нервной системы у новорожденных [18].
Количественный анализ концентрации НСЕ в сыворотке крови выполняли методом иммуноферментного анализа со специфическими тест-системами на основе моноклональных антител. Результаты записывали с помощью одноканального фотометра, а уровни НСЕ сравнивали в исследуемых подгруппах и контрольной группе.
Терапия / Therapy
Все дети в тяжелом состоянии получали лечение в отделении интенсивной терапии, которое включало различные методы: искусственная вентиляция легких, инфузионная, антибактериальная терапия и глюкокортикоидная терапия. Также они проходили комплексную синдромальную терапию с тщательным контролем состава крови и уровня различных веществ.
Статистический анализ / Statistical analysis
Подготовку данных и последующую статистическую обработку проводили в программах Microsoft Office Excel (Microsoft, США) и Statistica 10.0 (StatSoft Inc., США). Для проверки нормальности распределения использовали критерий Шапиро–Уилка. Наличие выбросов проверяли методом трех сигм. Тест показал нормальность распределения обрабатываемых выборок. Все результаты измерений представлены в тексте и графиках в виде среднего значения и стандартного отклонения (M±σ). Сравнение между группами в каждой временной точке выполняли с помощью однофакторного дисперсионного анализа (англ. analysis of variance, ANOVA) и теста Тьюки. Различия считали значимыми при p<0,05.
РЕЗУЛЬТАТЫ / RESULTS
Общая характеристика новорожденных / Overall characteristics of newborns
В контрольной группе состояние детей при рождении было удовлетворительным, баллы по шкале Апгар варьировались от 8 до 10. В основной группе при рождении у 23 (46,9%) новорожденных было тяжелое состояние, у 18 (36,7%) − средней тяжести, у 8 (16,3%) − удовлетворительное.
У всех детей основной группы были отмечены проявления перинатального гипоксически-ишемического повреждения: у 10 (20,4%) − I степени, у 32 (65,3%) − II степени, у 7 (14,3%) − III степени. У некоторых новорожденных также наблюдались респираторный дистресс-синдром, внутриутробная пневмония, конъюгационная гипербилирубинемия различных степеней, общий отечный синдром и внутриутробная недостаточность питания. С помощью нейросонографии подтверждены внутрижелудочковые кровоизлияния и перивентрикулярная лейкомаляция у 21 ребенка.
Соотношение уровня НСЕ с состоянием новорожденных / Interrelation of NSE level with newborns’ condition
В контрольной группе концентрация НСЕ в сыворотке крови не колебалась более 2,7±0,5 нг/мл в течение 24-недельного периода наблюдения. Однако в подгруппах А1–3, А4–6 и А7–9 отмечены статистически значимые различия по сравнению с контрольной группой на протяжении всего исследования (р<0,05), за исключением подгруппы А7–9 на 24-й неделе.
Примечательно, что значительные различия наблюдались между подгруппами А1–3 и А4–6 в течение 2-й и 3-й недель. После незначительного снижения на 4-й неделе концентрация НСЕ в сыворотке крови детей этих подгрупп вернулась к прежним значениям, составив 35,5±5,9 и 32,2±4,8 нг/мл соответственно. У новорожденных из подгруппы А7–9 также зафиксирована тенденция к увеличению уровня НСЕ, хотя и в меньшей степени, чем в подгруппах А1–3 и А4–6. С течением времени концентрация НСЕ в этой подгруппе постепенно снижалась до нормальных значений, тогда как в подгруппах А1–3 и А4–6 она оставалась повышенной до конца исследования. Подробные результаты представлены на рисунке 1.
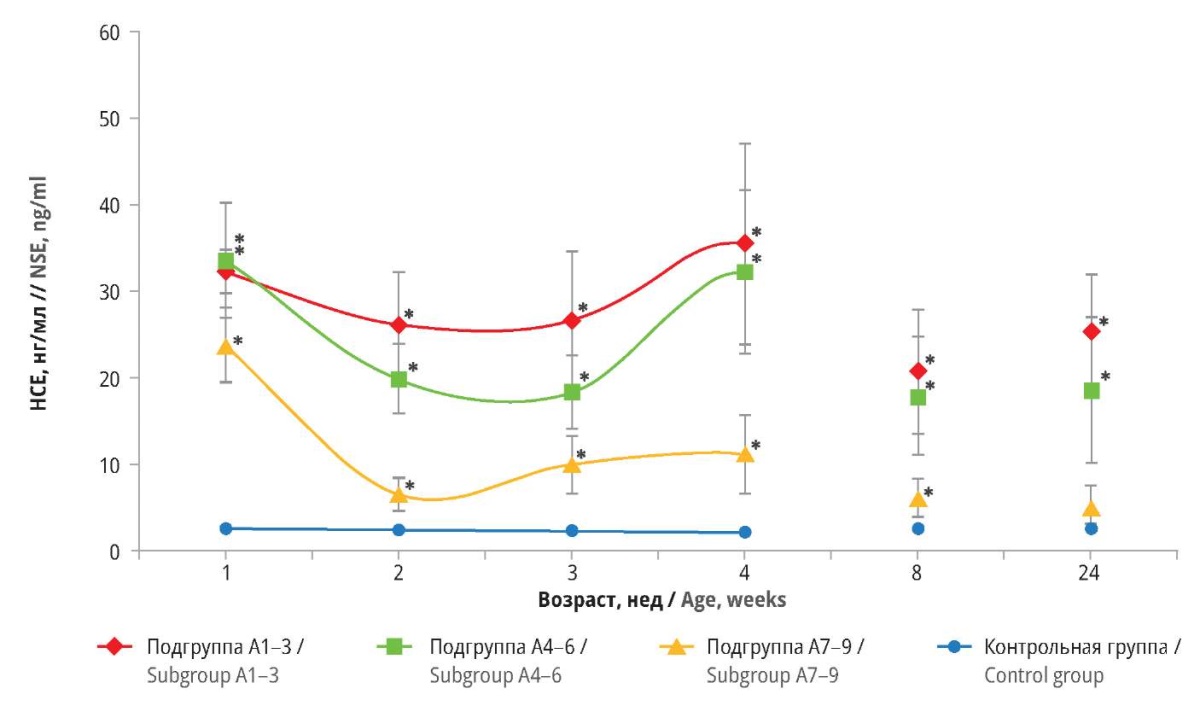
Рисунок 1. Сывороточная концентрация нейронспецифической енолазы (НСЕ) у детей
с перинатальным гипоксически-ишемическим поражением центральной нервной системы
и различными оценками по шкале Апгар на 1-й минуте после рождения.
* р<0,05 по сравнению с контрольной группой (сравнение проведено
с помощью однофакторного дисперсионного анализа ANOVA и теста Тьюки)
Figure 1. Serum concentration of neuron-specific enolase (NSE) in infants
with perinatal hypoxic-ischemic damage of central nervous system
and different assessments by Apgar scale at the 1st minute after birth.
* p<0.05 compared to the control group (the comparison was carried out
using ANOVA and Tukey test)
Соотношение уровня НСЕ с гестационным возрастом / Interrelation of NSE level with gestational age
У детей, перенесших перинатальное гипоксически-ишемическое поражение ЦНС на 32–33-й неделе беременности (подгруппа ГВ32–33), сывороточная концентрация НСЕ составила 43,4±45 нг/мл в течение 1-й недели. Для сравнения, у новорожденных в подгруппах ГВ34–36 и ГВ37–41 уровни НСЕ были ниже – 26,6±3,0 и 25,1±1,5 нг/мл соответственно. В контрольной группе концентрация НСЕ в сыворотке крови в течение 1-й недели составляла всего 2,5±0,5 нг/мл.
В ходе исследования концентрация НСЕ в подгруппе ГВ32–33 оставалась достоверно выше, чем в контрольной группе, а также в подгруппах ГВ34–36 и ГВ37–41. Однако к концу исследования различия в уровнях НСЕ между подгруппами ГВ34–36 и ГВ37–41 и контрольной группой уже не были статистически значимыми. С 1-й недели наблюдения во всех подгруппах отмечено постепенное снижение показателей содержания НСЕ в сыворотке крови. Однако в подгруппе ГВ32–33 оно прервалось начиная с 3-й недели, а в подгруппах ГВ34–36 и ГВ 37–40 – начиная со 2-й недели: показатели снова увеличились, достигнув наивысшей точки на 4-й неделе. В то же время в подгруппе ГВ32–33 отмечался более выраженный отсроченный рост концентрации НСЕ, который превысил даже исходный уровень и достиг 45,1±3,5 нг/мл.
В дальнейшем во всех подгруппах концентрация НСЕ в сыворотке крови снова снизилась. Однако на 24-й неделе в подгруппе ГВ32–33 продолжало сохраняться статистически значимое повышение уровня НСЕ по сравнению с контрольной группой. Подробные данные приведены на рисунке 2.
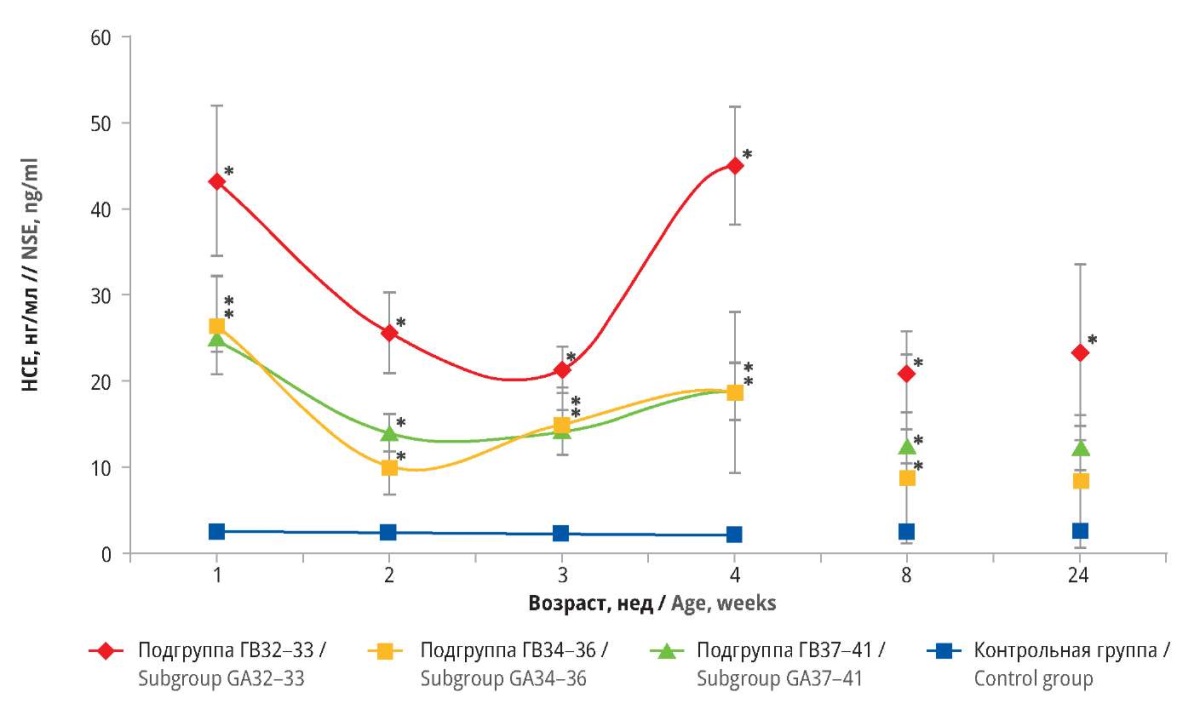
Рисунок 2. Сывороточная концентрация нейронспецифической енолазы (НСЕ)
в сыворотке крови у детей различного гестационного возраста (ГВ)
с перинатальным гипоксически-ишемическим поражением центральной нервной системы.
* р<0,05 по сравнению с контрольной группой (сравнение проведено
с помощью однофакторного дисперсионного анализа ANOVA и теста Тьюки)
Figure 2. Serum concentration of neuron-specific enolase (NSE)
in infants of different gestational age (GA)
with perinatal hypoxic-ischemic damage to central nervous system.
* p<0.05 compared to the control group
(the comparison was carried out using ANOVA and Tukey test)
Соотношение уровня НСЕ с видом повреждения ЦНС / Interrelation of NSE level with type of CNS damage
На протяжении всего исследования наблюдалась разница в сывороточной концентрации НСЕ между подгруппой ВЖК, подгруппой ПВЛ и контрольной группой (p<0,05). У новорожденных из подгруппы ВЖК указанные различия носили значимый характер в течение всего эксперимента. Однако в подгруппе ПВЛ различия уровней НСЕ по сравнению с контрольной группой не были статистически значимыми на 2-й, 8-й и 24-й неделях исследования (рис. 3).
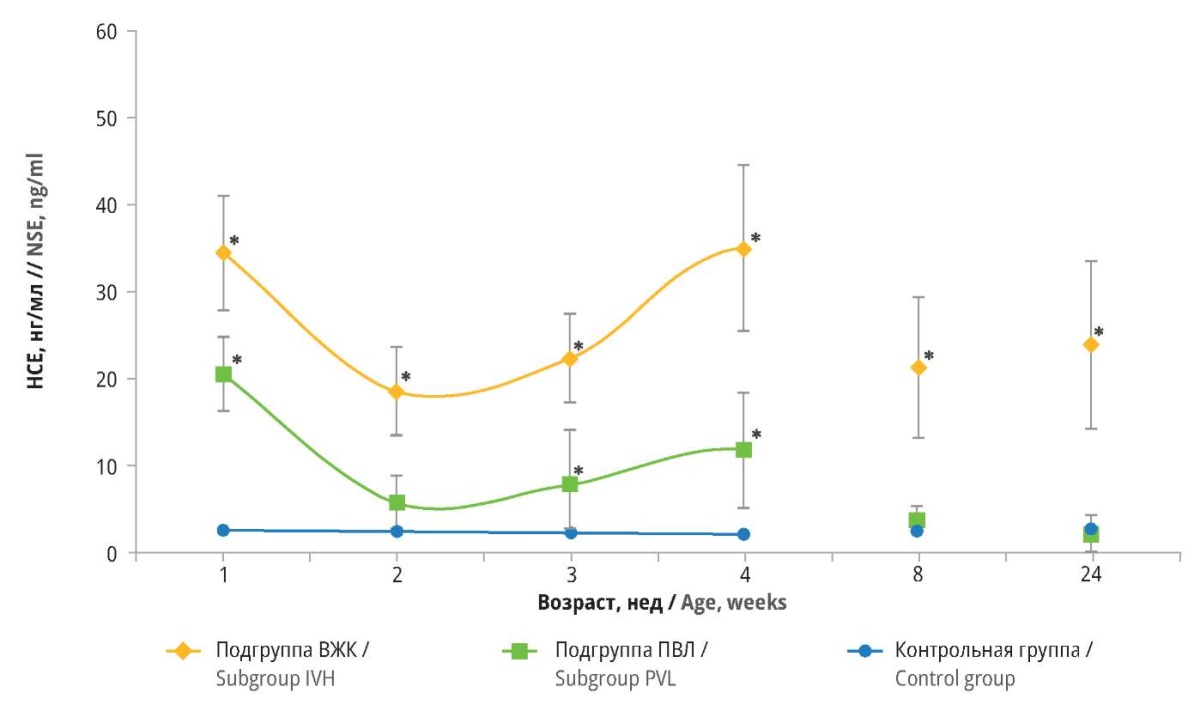
Рисунок 3. Сывороточные концентрации нейронспецифической енолазы (НСЕ)
у детей различного гестационного возраста c внутрижелудочковыми кровоизлияниями (ВЖК)
и перивентрикулярными лейкомаляциями (ПВЛ).
* р<0,05 по сравнению с контрольной группой (сравнение проведено
с помощью однофакторного дисперсионного анализа ANOVA и теста Тьюки)
Figure 3. Serum concentrations of neuron-specific enolase (NSE)
in infants of different gestational age with intraventricular hemorrhages (IVH)
and periventricular leukomalacia (PVL).
* p<0.05 compared to the control group
(the comparison was carried out using ANOVA and Tukey test)
Не менее интересной представляется динамика изменения сывороточной концентрации НСЕ в данных подгруппах. Вслед за начальным снижением уровня НСЕ на 2-й неделе жизни, наблюдавшимся в подгруппах ВЖК и ПВЛ, он снова повышался начиная с 3-й недели, достигнув пика на 4-й неделе. В подгруппе ВЖК концентрация НСЕ в сыворотке крови вернулась к исходным значениям 35,0±4,9 нг/мл. Однако в подгруппе ПВЛ пиковая концентрация НСЕ была менее выражена, составляя в среднем 11,8±2,2 нг/мл. В дальнейшем уровень НСЕ в подгруппе ПВЛ постепенно снижался, достигнув нормальных значений к концу исследования. Напротив, в подгруппе ВЖК по сравнению с контрольной группой сохранялись статистически значимые различия в сывороточных концентрациях НСЕ.
ОБСУЖДЕНИЕ / DISCUSSION
В настоящее время существуют проблемы в оценке эффективности медицинских вмешательств и программ реабилитации пациентов с поражением ЦНС. При этом своевременно оказанная реабилитационная поддержка таких больных может не только существенно улучшить качество жизни, но и снизить нагрузку на систему здравоохранения в дальнейшем [19]. Для анализа результатов лечения часто используются суррогатные конечные точки, такие как изменения структурных и функциональных показателей и биологических маркеров. Концентрация НСЕ в сыворотке крови может служить суррогатной конечной точкой при оценке реабилитационных технологий после гипоксически-ишемических поражений ЦНС. Диагностическая значимость НСЕ уже подтверждена в крупных клинических исследованиях [20][21].
В нашем исследовании установлено, что тяжесть перинатального поражения ЦНС обратно пропорциональна гестационному возрасту, что может быть связано с незрелостью органов и систем у недоношенных новорожденных, а также осложнениями внутриутробного развития. Обнаружено, что недоношенные дети имеют более низкую резистентность ГЭБ к поражениям ЦНС по сравнению с детьми с нормальным периодом беременности [22]. Другим клинически значимым изменением является отсроченное повторное повышение проницаемости ГЭБ для НСЕ, наблюдаемое через 4 нед после его выхода в периферический кровоток в 1-ю неделю жизни. Это соответствует экспериментальным исследованиям на лабораторных животных с моделью гипоксически-ишемического поражения ЦНС, где наблюдалось повторное и отсроченное увеличение нейроспецифических белков, маркеров нейронов и глии [23][24]. Данный феномен можно объяснить проникновением аутоантител к НСЕ через поврежденный ГЭБ к нейронам и закреплением хронически протекающего нейродегенеративного процесса. Функциональная целостность ГЭБ частично сохраняется при патологии нейронов, что ограничивает выход НСЕ в периферический кровоток.
Практический интерес также представляют различия в профилях высвобождения НСЕ у детей с ВЖК и ПВЛ. Концентрации НСЕ в сыворотке крови у новорожденных с ВЖК были стабильно в 2–3 раза выше, чем у детей с ПВЛ на протяжении всего периода наблюдения. К 8-й неделе уровни НСЕ в подгруппе ПВЛ были аналогичны таковым в контрольной группе. В исследовании рассматривались подгруппы детей, перенесших перинатальное гипоксически-ишемическое поражение ЦНС. На протяжении всего исследования более высокие уровни НСЕ в сыворотке были связаны с более тяжелым перинатальным гипоксически-ишемическим повреждением, о чем свидетельствует оценка по шкале Апгар.
Представленные данные демонстрируют наличие взаимосвязи между уровнем НСЕ и тяжестью состояния новорожденного. Закономерным будет рассмотреть возможность использования указанного биомаркера на еще более раннем периоде наблюдения. Так, результаты отдельных исследований указывают на высокую диагностическую значимость НСЕ в околоплодных водах. Этот биомаркер может служить маркером повреждения нейронов и коррелирует с такими расстройствами, как ВЖК и ПВЛ у плода [25][26]. Однако необходимо провести ряд подтверждающих исследований для широкого внедрения определения уровня НСЕ на этапе беременности, что поможет своевременно оказывать новорожденным должную реабилитационную поддержку.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Результаты исследования позволяют предположить, что нарушение проницаемости ГЭБ происходит при перинатальном гипоксически-ишемическом повреждении ЦНС. Антиген НСЕ выходит за пределы ГЭБ и служит маркером повреждения нейронов. Его концентрация в сыворотке крови может быть измерена для определения степени и характера поражения ЦНС, а также для оценки эффективности реабилитационных методов.
Список литературы
1. Ballabh P., Braun A., Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis. 2004; 16 (1): 1–13. https://doi.org/10.1016/j.nbd.2003.12.016.
2. Tran K.A., Zhang X., Predescu D., et al. Endothelial β-catenin signaling is required for maintaining adult blood-brain barrier integrity and central nervous system homeostasis. Circulation. 2016; 133 (2): 177–86. https://doi.org/10.1161/CIRCULATIONAHA.115.015982.
3. Блинов Д.В. Общность ряда нейробиологических процессов при расстройствах деятельности ЦНС. Эпилепсия и пароксизмальные состояния. 2016; 3 (2): 28–33.
4. Garga N., Lowenstein D.H. Posttraumatic epilepsy: a major problem in desperate need of major advances. Epilepsy Curr. 2006; 6 (1): 1–5. https://doi.org/10.1111/j.1535-7511.2005.00083.x.
5. Батышева Т.Т., Крапивкин А.И., Царегородцев А.Д. и др. Реабилитация детей с поражением центральной нервной системы. Российский вестник перинатологии и педиатрии. 2018; 62 (6): 7–15. https://doi.org/10.21508/1027-4065-2017-62-6-7-15.
6. Keller A., Peltzer J., Carpentier G., et al. Interactions of enolase isoforms with tubulin and microtubules during myogenesis. Biochim Biophys Acta. 2007; 1770 (6): 919–26. https://doi.org/10.1016/j.bbagen.2007.01.015.
7. Barbieri G., De Angelis L., Feo S., et al. Differential expression of muscle-specific enolase in embryonic and fetal myogenic cells during mouse development. Differentiation. 1990; 45 (3): 179–84. https://doi.org/10.1111/j.1432-0436.1990.tb00471.x.
8. Bock E., Dissing J. Demonstration of enolase activity connected to the brain-specific protein 14-3-2. Scand J Immunol. 1975; 4 (s2): 31–6. https://doi.org/10.1111/j.1365-3083.1975.tb03806.x.
9. Clark-Rosenberg R.L., Marangos P.J. Phylogenetic distribution of neuron-specific enolase. J Neurochem. 1980; 35 (3): 756–9. https://doi.org/10.1111/j.1471-4159.1980.tb03720.x.
10. Marangos P.J., Campbell I.C., Schmechel D.E., et al. Blood platelets contain a neuron-specific enolase subunit. J Neurochem. 1980; 34 (5): 1254–8. https://doi.org/10.1111/j.1471-4159.1980.tb09967.x.
11. DeGiorgio C.M., Correale J.D., Gott P.S., et al. Serum neuron-specific enolase in human status epilepticus. Neurology. 1995; 45 (6): 1134–7. https://doi.org/10.1212/wnl.45.6.1134.
12. Tomkins O., Friedman O., Ivens S., et al. Blood-brain barrier disruption results in delayed functional and structural alterations in the rat neocortex. Neurobiol Dis. 2007; 25 (2): 367–77. https://doi.org/10.1016/j.nbd.2006.10.006.
13. Zhang W., Zhu L., An C., et al. The blood brain barrier in cerebral ischemic injury – disruption and repair. Brain Hemorrhages. 2020; 1 (1): 34–53. https://doi.org/10.1016/j.hest.2019.12.004.
14. Бредбери М. Концепция гематоэнцефалического барьера. М.: Медицина; 1983: 480 с.
15. Чехонин В.П., Дмитриева Т.Б., Жирков Ю.А. Иммунохимический анализ нейроспецифических антигенов. М.: Медицина; 2000: 415 с.
16. Berger R., Garnier Y. Pathophysiology of perinatal brain damage. Brain Res Brain Res Rev. 1999; 30 (2): 107–34. https://doi.org/10.1016/s0165-0173(99)00009-0.
17. Морозова А.Ю., Милютина Ю.П., Ковальчук-Ковалевская О.В. и др. Содержание нейронспецифической енолазы и мозгового нейротрофического фактора в пуповинной крови доношенных новорожденных с задержкой внутриутробного развития. Журнал акушерства и женских болезней. 2019; 68 (1): 29–36. https://doi.org/10.17816/JOWD68129-36.
18. Немкова С.А., Заваденко Н.Н., Медведев М.И. Современные принципы ранней диагностики и комплексного лечения перинатальных поражений центральной нервной системы и детского церебрального паралича. M.; 2013. URL: https://rsmu.ru/fileadmin/templates/DOC/Faculties/PF/Dept_nnmg/publications/perinatal_porazhenija.pdf (дата обращения 15.09.2023).
19. Домбровский В.С., Омельяновский В.В. Проблемы выбора исходов для оценки эффективности программ реабилитации больных после инсульта и ЧМТ. ФАРМАКОЭКОНОМИКА Современная фармакоэкономика и фармакоэпидемиология. 2015; 7 (3): 20–5.
20. Abbasoglu A., Sarialioglu F., Yazici N., et al. Serum neuron-specific enolase levels in preterm and term newborns and in infants 1–3 months of age. Pediatr Neonatol. 2015; 56 (2): 114–9. https://doi.org/10.1016/j.pedneo.2014.07.005.
21. Elimian A., Figueroa R., Verma U., et al. Amniotic fluid neuron-specific enolase: a role in predicting neonatal neurologic injury? Obstet Gynecol. 1998; 92 (4 Pt 1): 546–50. https://doi.org/10.1016/s0029-7844(98)00273-7.
22. Чехонин В.П., Лебедев С.В., Дмитриева Т.Б. и др. Иммуноферментный анализ NSE и GFAP как критерий динамической оценки проницаемости гематоэнцефалического барьера крыс при перинатальном гипоксически-ишемическом поражении ЦНС. Бюллетень экспериментальной биологии и медицины. 2003; 136 (9): 299–303.
23. Baranova O., Miranda L.F., Pichiule P., et al. Neuron-specific inactivation of the hypoxia inducible factor 1α increases brain injury in a mouse model of transient focal cerebral ischemia. J Neurosci. 2007; 27 (23): 6320–32. https://doi.org/10.1523/JNEUROSCI.0449-07.2007.
24. Walton M., Connor B., Lawlor P., et al. Neuronal death and survival in two models of hypoxic-ischemic brain damage. Brain Res Brain Res Rev. 1999; 29 (2–3): 137–68. https://doi.org/10.1016/s0165-0173(98)00053-8.
25. Perrone S., Grassi F., Caporilli C., et al. Brain damage in preterm and full-term neonates: serum biomarkers for the early diagnosis and intervention. Antioxidants. 2023; 12 (2): 309. https://doi.org/10.3390/antiox12020309.
26. Wijnberger L.D.E., Nikkels P.G.J., Van Dongen A.J.C.M., et al. Expression in the placenta of neuronal markers for perinatal brain damage. Pediatr Res. 2002; 51 (4): 492–6. https://doi.org/10.1203/00006450-200204000-00015.
Об авторах
А. Г. АлександровРоссия
Александров Андрей Георгиевич, к.б.н.
Scopus Author ID: 57211350219
ул. Садовая-Триумфальная, д. 4/10, Москва 127006
ул. Быкова, д. 84Б, Ленинградская обл., Всеволожский р-н, Колтушское с/п, с. Павлово 188680
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович, к.м.н.
WoS ResearcherID: E-8906-2017
Scopus Author ID: 6701744871
ул. Садовая-Триумфальная, д. 4/10, Москва 127006
ул. 2-я Брестская, д. 5, стр. 1-1а, Москва 123056
ул. Трубецкая, д. 8/2, Москва 119048
Рецензия
Для цитирования:
Александров А.Г., Блинов Д.В. Прорыв гематоэнцефалического барьера после острой гипоксии головного мозга у детей. Реабилитология. 2024;2(1):107-114. https://doi.org/10.17749/2949-5873/rehabil.2024.13
For citation:
Aleksandrov A.G., Blinov D.V. Blood-brain barrier breach after acute cerebral hypoxia in infants. Journal of Medical Rehabilitation. 2024;2(1):107-114. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.13






