Перейти к:
Место реабилитации в ведении детей со спинальной мышечной атрофией
https://doi.org/10.17749/2949-5873/rehabil.2024.18
Аннотация
Актуальность. Спинальная мышечная атрофия (СМА) – тяжелое нервно-мышечное заболевание, которое сопровождается прогрессирующей слабостью проксимальных мышц и угрожает развитием паралича. Большинство пациентов с СМА являются детьми. Для абилитации и реабилитации детей с СМА требуется мультидисциплинарный подход с формированием команды специалистов, непрерывный контроль состояния здоровья ребенка.
Цель: представить предлагаемые в настоящее время мировым научным сообществом и практическим здравоохранением методы мониторинга клинического состояния и мероприятия по реабилитации детей с СМА 1–3-го типов, следование которым позволило бы им достичь максимально возможного уровня независимой жизни и мобильности, а также предотвратить или отсрочить развитие осложнений.
Материал и методы. Поиск первоисточников осуществлен в электронных базах данных Cochrane Library, Clinical Еvidence, Google Scholar, PubMed/MEDLINE, а также в Государственном реестре лекарственных средств Минздрава России, справочно-правовой системе «КонсультантПлюс», сервисах Google и Яндекс. Использованы ключевые слова и их комбинации на русском и английском языках, в т.ч. сокращенные обозначения: «спинальная мышечная атрофия», «СМА у детей», «нейромышечные заболевания», «нейромышечная дегенерация», «абилитация СМА», «реабилитация СМА», «физиотерапевтическое лечение СМА», «руководство по питанию при СМА», «упражнения при СМА», «физиотерапия СМА», «контрактуры СМА», «сколиоз СМА», «консенсус СМА», “spinal muscular atrophy”, “SMA in children”, “neuromuscular diseases”, “neuromuscular degeneration”, “SMA habilitation”, “SMA rehabilitation”, “SMA physiotherapy management”, “SMA nutrition guidelines”, “SMA exercise”, “SMA physical therapy”, “SMA contractures”, “SMA scoliosis”, “SMA consensus”. Принцип формирования обзора заключался во всестороннем представлении методов абилитации и реабилитации детей с СМА, поэтому отбирались материалы по лечебным практикам, социальному, психологическому, правовому и медико-экспертному ведению таких пациентов. Проанализированы работы, опубликованные за последние 10 лет, а также более ранние, представляющие весомый научный интерес. Исходно было получено 327 литературных источников, включая обзоры, метаанализы, результаты клинических исследований, материалы советов экспертов, клинические рекомендации и рекомендации научных сообществ по теме СМА 1–3-го типов у детей. После удаления дубликатов и проверки приемлемости публикаций в соответствии с критериями включения и невключения в обзор вошло 100 научных работ.
Результаты. Представлена реабилитационная команда специалистов, привлекаемая для ведения пациентов детского возраста с СМА. Описаны методы медицинской реабилитации, включающие управление дыханием, физические упражнения и растяжку, физиотерапию, управление питанием, ортезирование и ортопедию, симптоматическую фармакотерапию, техническую мобильность, технологический и эргометрический менеджмент, зоотерапию, хирургическое вмешательство на позвоночнике и суставах. Освещены вопросы эмоциональной, психологической и поведенческой, социальной, образовательной (в т.ч. генетическое консультирование) поддержки семьи. Рассмотрены консенсусные заявления ведущих экспертов по СМА, клинические рекомендации, практики научных сообществ.
Заключение. В научной литературе представлены различные методы лечения СМА 1–3-го типов у детей с учетом мультидисциплинарного подхода и мониторинга профессиональной командой, состоящей из специалистов разных областей медицины. Помимо вопросов традиционной терапии рассматриваются новые методы сочетанного лечения заболевания (традиционное ведение + модифицирующая СМА-терапия), а также вопросы социального, психологического, правового и медико-экспертного сопровождения. Пациенты с СМА нуждаются в структурированной программе комплексной реабилитации, которая должна разрабатываться на индивидуальной основе.
Ключевые слова
Для цитирования:
Катикова О.Ю. Место реабилитации в ведении детей со спинальной мышечной атрофией. Реабилитология. 2024;2(2):227-246. https://doi.org/10.17749/2949-5873/rehabil.2024.18
For citation:
Katikova O.Yu. Rehabilitation in children with spinal muscular atrophy. Journal of Medical Rehabilitation. 2024;2(2):227-246. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.18
ВВЕДЕНИЕ / INTRODUCTION
Спинальная мышечная атрофия (СМА) – тяжелое нервно-мышечное заболевание, генетически наследуемое по аутосомно-рецессивному типу, которое обусловлено дегенерацией α-мотонейрона 1, или мутациями в гене SMN1 (англ. survival motor neuron 1), в спинном мозге и стволе головного мозга, сопровождается прогрессирующей слабостью проксимальных мышц и угрожает развитием паралича [1–3]. СМА – группа клинически и генетически гетерогенных наследственных орфанных заболеваний. В соответствии с Международной классификацией болезней 10-го пересмотра СМА относится к заболеваниям нервной системы (G12).
СМА имеет низкую распространенность: в среднем 1 ребенок на 11 тыс. родов [4]. Относительно высокая распространенность наблюдалась в исследованиях, проведенных в Италии и Скандинавии: на 100 тыс. человек 6,56 и 4,18 случая у людей в возрасте до 20 лет и до 18 лет соответственно [5]. В Канаде ежегодно регистрируется 37,2 новых случая СМА всех подтипов [6]. Существует более высокая заболеваемость СМА в странах, где распространены близкородственные браки: около 69% людей, страдающих СМА в Турции, имели в анамнезе кровнородственные браки [7][8]. В Саудовской Аравии сообщалось о распространенности 13,26 случая на 100 тыс. живорождений [5].
Статистика по Российской Федерации (РФ) отсутствует. СМА входит в Перечень редких (орфанных) заболеваний, утвержденный Минздравом России, по состоянию на 31 мая 2024 г. [9]. Однако СМА не включена в «льготные» перечни орфанных заболеваний (программу «14 высокозатратных нозологий» [10], перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности [11]), при которых осуществляется обеспечение больных дорогостоящими лекарственными препаратами за счет средств федерального бюджета.
СМА имеет тяжелые проявления, приводящие к инвалидности пациентов. Большинство больных СМА являются детьми, в т.ч. в возрасте до 3 лет.
Заболевание включает широкий спектр фенотипов, классифицированных на пять основных клинических типов в зависимости от возраста начала и достигнутых этапов развития двигательной функции (табл. 1).
Таблица 1. Классификация типов спинальной мышечной атрофии (СМА)
Table 1. Classification of spinal muscular atrophy (SMA) types
Тип СМА / SMA type | Возраст дебюта / Age of onset | Максимально достигнутая двигательная функция / Highest achieved motor function | Естественный возраст смерти / Natural age of death | Клинические проявления / Clinical manifestations |
Тип 0 / Type 0 [3][12] | Внутриутробно / | – | Внутриутробная гибель плода или ранний младенческий возраст / | Задержка развития и снижение подвижности плода. В большинстве случаев беременности происходит внутриутробная гибель, а в случае родоразрешения новорожденные умирают от дыхательной недостаточности / Developmental delay and decreased fetal mobility. In most cases of pregnancy, intrauterine death occurs, and in case of delivery, newborns die from respiratory failure |
Тип 1 (болезнь Верднига–Гоффмана) / Type 1 (Werdnig–Hoffmann disease) [1][4][7] | 0–6 мес / | Не сидит / | До 2 лет / | Глубокая слабость и гипотония, трудности контроля головы, слабый крик и кашель, трудности с глотанием и выделением слюны, осложненное течение заболеваний из-за дыхательной недостаточности и аспирационной пневмонии / Profound weakness and hypotension, difficulty controlling the head, weak screaming and coughing, difficulty swallowing and salivating, complicated course of illness due to respiratory failure and aspiration pneumonia |
Тип 2 (болезнь Дубовица) / Type 2 (Dubowitz disease) [2][5][8] | 6–18 мес / | Не стоит / | Более 2 лет / | Задержка моторного развития и набора веса, слабый кашель, тремор рук, контрактуры и сколиоз / Delayed motor development and weight gain, weak cough, hand tremors, contractures and scoliosis |
Тип 3 (болезнь Кугельберга–Веландера) / Type 3 (Kugelberg–Welander disease) [4][6] | Старше 18 мес / | Стоит и ходит / | Подростковый возраст / | Мышечная слабость различной степени выраженности, крампи, контрактуры и гипермобильность суставов, потеря способности ходить с некоторого момента жизни / Muscle weakness of varying severity, cramps, contractures and hypermobility of joints, loss of the ability to walk from some point in life |
Тип 4 (поздний тип) / Type 4 (late type) [3][8] | В подростковом или взрослом возрасте / Adolescents or adults | Может потерять способность к самостоятельному передвижению / May lose the ability to move independently | Зрелый возраст / Adult | Прогрессирующая проксимальная мышечная слабость, снижение сухожильных рефлексов, фасцикуляции / Progressive proximal muscle weakness, decreased tendon reflexes, fasciculations |
Поскольку заболевание до недавних пор считалось некурабельным, исторически использовался поддерживающий терапевтический подход [12]. Однако появление инновационных методов лечения, модифицирующих болезнь, изменило парадигму СМА, особенно ее тяжелой формы (1-й тип) [13]. Препаратами, модифицирующими заболевание, в настоящее время признаны нусинерсен [14][15], который был первым одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США (англ. US Food and Drug Administration, FDA) в 2016 г., а также онасемноген абепарвовек и рисдиплам [14].
Оригинальный препарат патогенетического лечения СМА Спинраза® (международное непатентованное наименование (МНН) нусинерсен) – раствор для интратекального введения с дозировкой 2,4 мг/мл (держатель регистрационного удостоверения (РУ) – Биоген Нидерландз Б.В. (Нидерланды), производители готовой лекарственной формы – Веттер Фарма-Фертигунг ГмбХ и Ко. КГ (Германия) и Патеон Италия С.п.А. (Италия), зарегистрирован в РФ (№ РУ ЛП-005730 от 16.08.2019)) [16]. Генотерапевтический препарат для лечения СМА Золгенсма® (МНН онасемноген абепарвовек) – раствор для инфузий (держатель РУ – Новартис Фарма АГ (Швейцария), производитель готовой лекарственной формы – Новартис Генные Терапии, Инк. (США), зарегистрирован в РФ (№ РУ ЛП-№(001462)-(РГ-RU) от 28.11.2022)) [17]. Препарат для лечения СМА Эврисди® (МНН рисдиплам) – порошок для приготовления раствора для приема внутрь 0,75 мг/мл (держатель РУ и производитель готовой лекарственной формы – Ф. Хоффманн-Ля Рош Лтд. (Швейцария), зарегистрирован в РФ (№ РУ ЛП-006602 от 26.11.2020)) [18].
С появлением средств, модифицирующих течение СМА, врачи постепенно меняют взгляды в сторону более активного лечения, которое должно быть междисциплинарным и включать меры всесторонней реабилитации. Патогенетическая фармакотерапия этого тяжелого заболевания будет иметь лучший результат при сопровождении адекватными мероприятиями по реабилитации [12]. Пациенты нуждаются в структурированной программе реабилитации, включающей мониторинг клинического состояния и имплементацию реабилитационного плана, который должен быть разработан на индивидуальной основе для каждого больного.
Цель – представить предлагаемые в настоящее время мировым научным сообществом и практическим здравоохранением методы мониторинга клинического состояния и мероприятия по реабилитации детей с СМА 1–3-го типов, следование которым позволило бы им достичь максимально возможного уровня независимой жизни и мобильности, а также предотвратить или отсрочить развитие осложнений.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
Поиск первоисточников осуществлен в электронных базах данных Cochrane Library, Clinical Еvidence, Google Scholar, PubMed/MEDLINE, а также в Государственном реестре лекарственных средств Минздрава России, справочно-правовой системе «КонсультантПлюс», сервисах Google и Яндекс.
Использованы ключевые слова и их комбинации на русском и английском языках, в т.ч. сокращенные обозначения: «спинальная мышечная атрофия», «СМА у детей», «нейромышечные заболевания», «нейромышечная дегенерация», «абилитация СМА», «реабилитация СМА», «физиотерапевтическое лечение СМА», «руководство по питанию при СМА», «упражнения при СМА», «физиотерапия СМА», «контрактуры СМА», «сколиоз СМА», «консенсус СМА», “spinal muscular atrophy”, “SMA in children”, “neuromuscular diseases”, “neuromuscular degeneration”, “SMA habilitation”, “SMA rehabilitation”, “SMA physiotherapy management”, “SMA nutrition guidelines”, “SMA exercise”, “SMA physical therapy”, “SMA contractures”, “SMA scoliosis”, “SMA consensus”.
Принцип формирования обзора заключался во всестороннем представлении методов абилитации и реабилитации детей с СМА 1–3-го типов, поэтому отбирались материалы по лечебным практикам, социальному, психологическому, правовому и медико-экспертному ведению таких пациентов. Проанализированы материалы, опубликованные за последние 10 лет, и более ранние работы, представляющие весомый научный интерес.
Актуальность обзора обусловлена недавним (с 2016 г.) появлением средств патогенетической терапии СМА, поэтому особое внимание уделено ревизии тактики традиционного ведения пациентов и применению более активного сочетанного лечения (классическое + модифицирующее заболевание) с ожиданием положительного прогноза.
Отбор публикаций / Selection of publications
Исходно анализировали 328 источников по теме СМА 1–3-го типов у детей, включая обзоры литературы (в т.ч. систематические обзоры), метаанализы, результаты клинических исследований, материалы советов экспертов, клинические рекомендации, описания единичных случаев из клинической практики, абстракты, рекомендации научных сообществ, материалы конференций, справочную литературу, документы Минздрава России (в т.ч. инструкции по медицинскому применению лекарственных препаратов), постановления Правительства РФ. При отборе материалов акцент был сделан на фундаментальные работы: обзоры (в т.ч. систематические и метаанализы), опубликованные результаты клинических исследований, а также на мнение экспертов (англ. key opinion leaders) и консенсусные заявления. Блок-схема отбора публикаций представлена на рисунке 1.
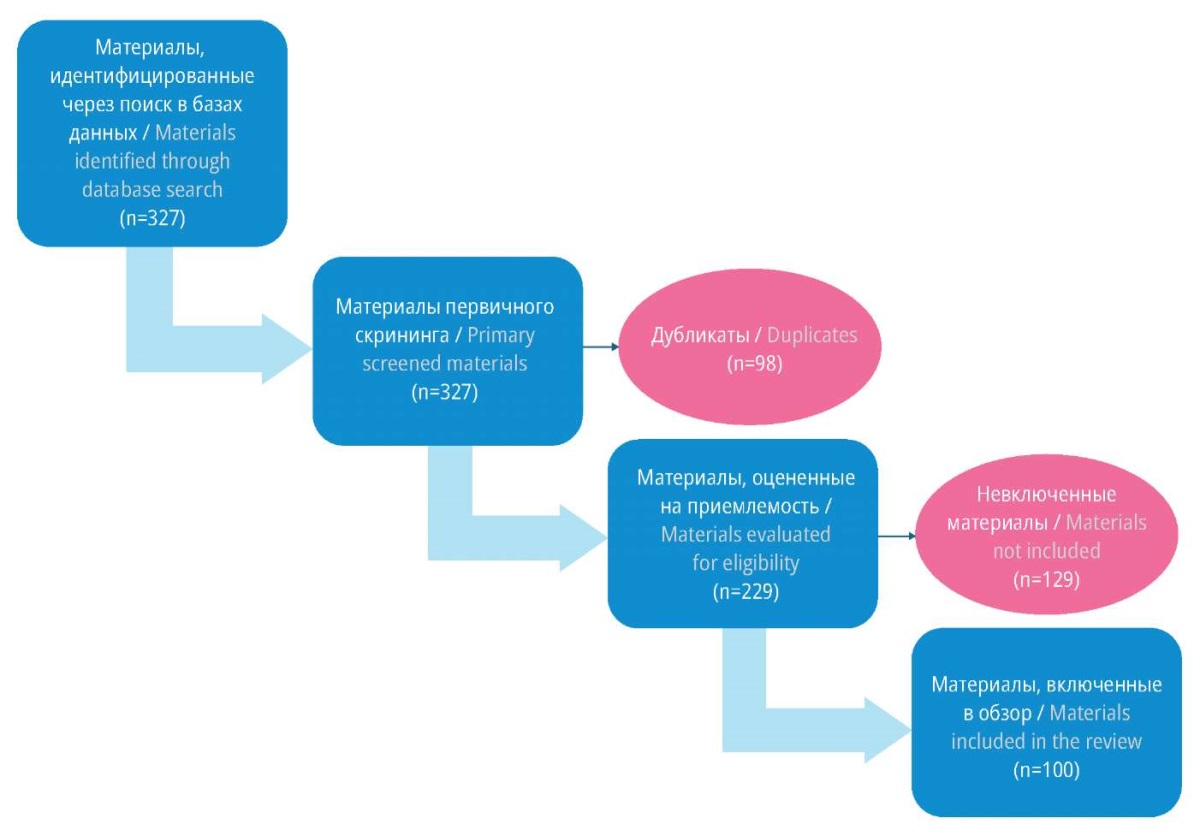
Рисунок 1. Блок-схема отбора публикаций
Figure 1. The flowchart for selection of publications
После первоначального ознакомления с собранными материалами удалены дубликаты, например материалы с повторами описания методов мониторинга и оценки состояния здоровья пациентов с СМА. Следующим этапом осуществлена оценка материалов на приемлемость с учетом соблюдения критериев отбора.
Критерии включения
В обзор включали материалы по следующим критериям:
- научная новизна;
- совершенная структура – информативность, четко сформулированная цель (предпочтительной целью в лечебной реабилитации являлось изучение эффективности и безопасности), детально оформленная методология, соответствие результатов и выводов поставленной цели, продемонстрированная наглядность, статистическая значимость (где выборка пациентов с этим орфанным заболеванием позволила оценить достоверность);
- мнения ведущих лидеров, экспертов по данной патологии (репутация авторов и их цитируемость);
- публикации в рецензируемых изданиях;
- материалы лечебных практик от научных сообществ;
- современность (предпочтительный срок выхода материала в печать – последние 5 лет).
Критерии невключения
Часть источников не была включена:
- исследования патогенетической терапии СМА:
- генно-заместительной терапии (эффективность и безопасность онасемногена абепарвовек),
- на основе антисмыслового олигонуклеотида (эффективность и безопасность нусинерсена),
- модификатора сплайсинга предшественника матричной рибонуклеиновой кислоты SMN2(эффективность и безопасность рисдиплама, в т.ч. когда при терапии нусинерсеном наблюдалось плато или снижение мышечных функций);
- исследования СМА 0-го типа, в т.ч. у новорожденных в неонатальный период;
- статьи о постановке диагноза СМА и скрининговых программах обследования;
- статьи с исследованиями фармакокинетики средств, предлагаемых для лечения СМА (рисдиплам, вальпроевая кислота);
- статьи о применении для лечения СМА средств симптоматической терапии, которые не входят в клинические рекомендации по лечению проксимальной СМА (гидроксимочевины, вальпроевой кислоты);
- статьи по многообразию фенотипов СМА;
- незавершенные клинические исследования (набор пациентов завершен, но результаты не опубликованы или на рассмотрении в странах заявленной регистрации);
- статьи, цель которых состояла не в оценке эффективности и безопасности, а лишь в проверке осуществимости методов (например, силовых тренировок) и выявлении потенциальных препятствий к их выполнению;
- клинические исследования, не соответствующие правилам надлежащей клинической практики стран Международной конференции по гармонизации технических требований для регистрации лекарственных средств для применения человеком (англ. International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use) – например, когда недоступны первичные данные для верификации по причине того, что главный исследователь (англ. principal investigator) покинул институт;
- статьи с патофизиологическим представлением механизмов непереносимости физических упражнений и стойкой мышечной утомляемости при СМА;
- публикации с малоинформативными абстрактами.
Результаты скрининга
После тщательно проведенного скрининга и оценки материалов на приемлемость в соответствии с критериями отбора в обзор включено 100 научных публикаций, из них 91 на английском языке и 9 на русском. Среди них 23 обзорные полнотекстовые статьи, 2 метаанализа, 34 публикации с результатами клинических исследований, 3 сообщения о ведении единичных пациентов с СМА, 6 клинических рекомендаций, 4 заключения советов экспертов, 4 сообщения от научных сообществ, 16 абстрактов, 1 справочник, 1 материал конференции, 4 документа Минздрава России и 2 постановления Правительства РФ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Команда реабилитации / Rehabilitation team
Для абилитации и реабилитации детей с СМА требуется мультидисциплинарный подход с формированием команды специалистов из разных областей медицины: пульмонолог, гастроэнтеролог, диетолог, нефролог, эндокринолог, физиотерапевт, массажисты, кинезиолог, эрготерапевт, логопед, сомнолог, ортопед, узкопрофильные специалисты в области акватерапии, зоотерапии, иглоукалывания и др., а также консультанты из научных сообществ и практических сфер психологии, психиатрии, социологии [12][19][20].
Профессиональная медицинская и социально-психологическая команда с обеспечением эмоциональной поддержки, с мерами финансовой помощи и защиты позволит родителям или людям, осуществляющим уход, полноценно заботиться о ребенке с СМА. Такой подход одобрен и практикуется в США, Германии и других странах [21]. В 2016 г. была создана программа комплексного многопрофильного медицинского наблюдения за пациентами с СМА в Израиле.
Медицинская реабилитация / Medical rehabilitation
Рассматриваемые в статье методы медицинской реабилитации СМА схематично представлены на рисунке 2.

Рисунок 2. Медицинская реабилитация детей со спинальной мышечной атрофией
включает управление дыханием, физические упражнения и растяжку,
физиотерапию, управление питанием, ортезирование и ортопедию,
симптоматическую фармакотерапию, техническую мобильность,
технологический и эргометрический менеджмент, зоотерапию,
хирургическое вмешательство на позвоночнике и суставах (составлено автором)
Figure 2. Medical rehabilitation in children with spinal muscular atrophy
includеs respiratory management, exercise and stretching,
physical therapy, nutritional management, orthotics and orthopedics,
symptomatic pharmacotherapy, technical mobility,
technological and ergometric management, animal therapy,
spine and joint surgery (drawn by the author)
Управление дыханием
Легочные патологии являются частой причиной заболеваемости и основной причиной смертности среди пациентов с СМА 1–2-го типов [13][22].
Все больные, способные выполнять спирометрию, должны быть обследованы во время каждого запланированного визита. Нарушение функции дыхательных мышц приводит к затруднению кашля, плохому выведению секрета из нижних дыхательных путей, гиповентиляции во время сна, прогрессирующей гиповентиляции в дневное время, недоразвитию грудной клетки и легких, а также к рецидивирующим инфекциям, которые усугубляют мышечную слабость [23].
Жизненная емкость легких (ЖЕЛ) и форсированная жизненная емкость легких (ФЖЕЛ) являются основными параметрами мониторинга функции дыхательных мышц у пациентов с СМА [24]. Риск легочных осложнений увеличивается по мере снижения ФЖЕЛ. Рекомендуемая частота обследования после постановки диагноза СМА – каждые 3–6 мес у несидящих и сидящих пациентов и реже у тех, кто ходит [25].
Измерения пиковой скорости выдоха (англ. peak expiratory flow, PEF) и пиковой скорости кашля (англ. peak сough flow, PCF) используют для мониторинга эффективности кашля и силы дыхания [26]. Применимы метод вынужденных колебаний (англ. forced oscillation method, FOT) и расчет индекса клиренса легких (англ. lung clearance index, LCI). Спирометрия и тестирование методом вынужденных колебаний используются у детей с СМА в возрасте от 3 лет [4].
Каждому пациенту с СМА рекомендуется проходить ежегодную вакцинацию против гриппа и пневмококковой инфекции. Все остальные плановые прививки должны выполняться в качестве рекомендуемого стандарта лечения, если только команда медицинских работников не посоветует иное [27].
Постоянное внимание следует уделять очистке дыхательных путей и улучшению вентиляции. Мануальные методы включают перкуссию, вибрацию и позиционирование для улучшения постурального дренажа. Это особенно важно во время обострения респираторного заболевания, в периоперационный период и в качестве профилактического лечения легких [19]. Для клиренса дыхательных путей показан такой метод, как оральное отсасывание [28]. У несидящих пациентов использование механического аспирационного насоса и катетера для пероральной аспирации является важнейшим элементом очистки дыхательных путей [29]. Сидячим людям рекомендуется выполнять очистку дыхательных путей по мере необходимости. Ходячим пациентам может потребоваться очистка дыхательных путей после операции или во время обострения респираторного заболевания.
Педиатры обучают родителей и лиц, осуществляющих уход, методам позиционного дренажа грудной клетки, а также помогают определиться с техниками и приемами кашля и дыхания – например, научат членов семьи играм с выдуванием мыльных пузырей или сдуванием легких предметов, чтобы тренировать дыхательные мышцы ребенка с СМА [30].
Ежедневный вспомогательный кашель рекомендуется пациентам с более тяжелыми формами и ограничением мобильности.
Симптоматическая поддерживающая терапия может включать неинвазивную вентиляцию легких (НИВЛ), трахеостомию, постоянную инвазивную вентиляцию легких (ИВЛ).
Методы набора объема воздуха полезны для пациентов со сниженной ЖЕЛ. Можно проводить ИВЛ с помощью ручного вентиляционного мешка [31]. Укрепление инспираторных мышц полезно вне периодов клинического обострения.
Варианты респираторной поддержки включают НИВЛ с двухуровневым положительным давлением (англ. biphasic positive airway pressure, BIPAP) или постоянным положительным давлением в дыхательных путях (англ. сontinuous positive airway pressure, CPAP) [32]. Респираторные приспособления подбираются в зависимости от варианта и тяжести затруднения дыхания. НИВЛ у младенцев с СМА может предотвратить изменения формы грудной клетки, ускорить рост легких, замедлить потерю податливости грудной стенки, снизить частоту инфекции и госпитализации [19]. Обычные показания к НИВЛ включают гиповентиляцию или обструктивное апноэ во сне [20][33]. Ограничениями НИВЛ являются сложность определения подходящего интерфейса и осложнения при применении интерфейса в течение длительных периодов времени (>16 ч/сут), включая раздражение кожи, упадок сил, гипоплазию средней зоны лица, вздутие живота и рвоту [34].
Пациенты с нервно-мышечными заболеваниями подвержены нарушениям сна, главным образом из-за гиповентиляции и апноэ. Ночная гиповентиляция является распространенным, но недостаточно диагностируемым осложнением у детей с СМА [35]. При отсутствии ИВЛ дети с СМА 1-го типа обычно не доживают до первых двух лет жизни. Однако для СМА 2-го типа подтипов 2a и 2b расчетные показатели выживаемости без необходимости ИВЛ составляют 81% и 67,7% соответственно [4]. В исследовании, проведенном в Европе, распространенность нарушения дыхания во сне при СМА 2–3-го типов составила 16,4% [35]. По данным Американского торакального общества (англ. American Thoracic Society, ATS), нарушения дыхания во сне у детей характеризуются длительной частичной обструкцией верхних дыхательных путей и/или периодической полной обструкцией (обструктивное апноэ), что нарушает нормальную вентиляцию во время сна и типичный режим сна, ухудшает газообмен. Причиной является слабость бульбарных мышц, предрасполагающая к коллапсу верхних дыхательных путей [12].
Исследование сна всегда должно проводиться у пациентов с симптомами или при минимальном подозрении на ночную гиповентиляцию. Полисомнография используется для оценки режима сна, дыхания и необходимости применения НИВЛ у педиатрических пациентов с СМА [36]. Оксиметрия считается приемлемым методом скрининга ночной гиповентиляции у бессимптомных детей. Все дети с отклонениями от нормы ночной оксиметрии должны подвергаться более детальному мониторингу сна с помощью чрескожного измерения парциального давления кислорода (pO2) или двуокиси углерода (pCO2) в крови [37]. Дальнейшее исследование должно включать рентгенографию грудной клетки. Ночную гипоксемию и гиперкапнию желательно выявить на ранней стадии, чтобы предотвратить появление дневных симптомов, а также негативных нейрокогнитивных и сердечных последствий.
Для управления гиповентиляцией во сне применимы CPAP-аппараты, которые работают по методу вентиляции легких положительным постоянным давлением на двух уровнях: давление для засыпания и лечебное давление, настраиваемое вручную или автоматически, в зависимости от потребности – от лечебного давления до максимального.
Физические упражнения и растяжка
Несмотря на то что в последнее время существенно увеличилось количество данных в пользу физических упражнений у пациентов с СМА, нет единого мнения относительно типа, частоты и интенсивности упражнений. Не существует универсального подхода к упражнениям для развития выносливости и силы при СМА [38].
Всем больным СМА рекомендуется заниматься упражнениями на гибкость независимо от уровня их подвижности, чтобы улучшить мобильность и уменьшить боль, не допустить гипотрофии и увеличить мышечную силу, снизить риск постоянного укорочения и сжатия суставов и развития контрактур, предотвратить долгосрочные последствия иммобилизации, такие как остеопороз и переломы [39]. Контрактуры могут привести к ограничению подвижности и мобильности, что существенно снизит качество повседневной жизни.
Методы физических упражнений и растяжки включают активно-вспомогательные и пассивные техники. Врачи по лечебной физкультуре (ЛФК) и физиотерапевты помогают предотвратить скованность суставов и повысить гибкость у детей с СМА, разрабатывая специальные программы упражнений на диапазон движений (англ. range of motion, ROM), позиционирование и регулярную растяжку [25]. Упражнения ROM имеют решающее значение для поддержания гибкости суставов. Физиотерапевтические упражнения четырех уровней (пассивные упражнения, активные упражнения с помощником, активные упражнения, резистивные упражнения) следует выполнять под руководством супервайзера – врача ЛФК или физиотерапевта.
Родители и лица, осуществляющие уход, также должны быть обучены выполнению ежедневных практик. Игры и забавные задания, направленные на повышение физических сил и выносливости ребенка, проводятся для обучения управлению головой и туловищем, повышения мобильности на полу (например, с помощью перекатывания или ползания, изменения положения тела, подтягивания и приподнимания туловища, вставания), отработки вертикальных навыков, таких как сидение, стояние и ходьба [30]. Стояние с поддержкой важно для облегчения растяжки нижних конечностей и улучшения осанки позвоночника и туловища [12]. При необходимости физиотерапевт может порекомендовать использование шин, брекетов или устройств для стояния. Вертикальная рама улучшает плотность костей, выравнивание позвоночника, длину мышц, желудочно-кишечную и легочную функции, а также когнитивную и социальную активность. Реабилитационная команда должна стремиться к тому, чтобы ребенок мог достичь и поддерживать положение стоя с опорой, которое защищает дыхательные пути, под пристальным наблюдением во время стояния. Оптимальная частота – 5–7 раз в неделю [19][20].
Сочетание фармакотерапии нусинерсеном с физическими упражнениями у пациентов с СМА более эффективно в улучшении двигательных навыков, чем использование только фармакологического лечения [40].
Продолжительность и частота проведения сеанса эффективной растяжки зависят от конкретных возможностей пациента, состояния позвоночника и суставов и целей реабилитации: минимум 3–5 раз в неделю для несидящих больных, 5–7 раз в неделю для сидящих [19].
Обзор F.A. Rathore и A. Afridi показал, что у 92,4% пациентов отмечен положительный эффект занятий по растяжке [41]. Среди методов растяжки наиболее распространены и применяются стойки или пассивная растяжка, дневное шинирование/фиксация, ночное шинирование/фиксация, растяжка с активной помощью, йога, положение лежа на клине. Продолжительность растяжки индивидуальна, она должна проводиться при конечном угле с учетом физических возможностей пациента.
ЛФК может включать укрепление корпуса с помощью полос сопротивления; изометрические сокращения туловища и шеи во всех направлениях; сгибание шеи и туловища вперед, разгибание туловища, а также боковые сгибания с двух сторон; эксцентрические и концентрические сокращения в одних и тех же направлениях, чтобы контролировать сокращение мышцы или возвращение в нейтральное положение с каждого направления; улучшение баланса сидя, чтобы обеспечить безопасность в повседневной деятельности [42].
Аэробные упражнения стимулируют двигательную функцию и повышают качество жизни пациентов с СМА. Согласно исследованиям, оптимальная продолжительность отдельных занятий аэробными упражнениями составляет ≥30 мин с минимальной частотой 2 или 3 раза в неделю и оптимальной частотой 3–5 раз в неделю [19]. Протокол аэробных упражнений для больных СМА не должен приводить к сильной усталости или боли во время и/или после тренировки [43].
Низкая и умеренная интенсивность аэробных упражнений и интервальные тренировки могут быть безопасным видом упражнений у пациентов с СМА, как это было показано при спинальной бульбарной мышечной атрофии. Комбинированные аэробные и силовые упражнения умеренной интенсивности хорошо переносились больными СМА 3-го типа [44].
Что касается силовых упражнений, тренировки с субмаксимальным отягощением хорошо переносятся пациентами с СМА 2–3-го типов с некоторым улучшением силы и отсутствием нежелательных явлений [45]. Однако в недавнем Кокрейновском обзоре авторы пришли к выводу, что неясно, полезны или лишены эффективности комбинированные силовые и аэробные упражнения для людей с СМА 3-го типа [41]. Не выявлено существенной разницы в увеличении расстояния ходьбы или улучшении качества жизни между группой упражнений и группой обычного ухода.
Несидящие пациенты могут участвовать в водных упражнениях при условии правильной поддержки головы и шеи и постоянного наблюдения. Для любителей ходьбы тренировка равновесия также должна быть частью программы реабилитационных упражнений. Усталость и мышечная боль во время или после тренировок указывают на чрезмерную нагрузку, поэтому следует пересмотреть их интенсивность и частоту [46][47].
Физические тренировки при лечении СМА защищают мышцы от истощения, улучшают кардиореспираторную функцию и физическую форму, а также предотвращают контрактуры. Исследование А. Lewelt et al. [48] показало, что упражнения с прогрессивным сопротивлением безопасны и хорошо переносятся детьми с СМА. В исследовании приняли участие 9 детей, которые прошли 12 нед домашних тренировок с прогрессивным сопротивлением под присмотром. Значительные улучшения наблюдались в общем совокупном балле ручного мышечного тестирования (англ. manual muscle testing, ММТ), но никаких существенных изменений в количественном мышечном анализе и измерениях ручной динамометрии не наблюдалось [48]. Исследование с участием 14 пациентов с СМА продемонстрировало, что программа силовых тренировок и езды на велосипеде на дому может переноситься и безопасно выполняться детьми с СМА, а также потенциально увеличить их максимальную аэробную способность – максимальное потребление кислорода (VO2max) в течение 6 мес. Однако по истечении 6-месячного периода не наблюдалось никаких существенных изменений в таких показателях, как утомляемость, качество жизни, сила или двигательная функция, а также пройденное расстояние в тесте 6-минутной ходьбы (англ. 6 Minutes Walking Test, 6MWT) [44]. В обоих исследованиях участвовало относительно небольшое количество пациентов с СМА.
Показано, что 12-недельная тренировка на эргометре улучшила окислительную способность, но не функцию у 6 пациентов с СМА 3-го типа [49].
Езда на велосипеде также улучшает мышечную силу и осанку, улучшает баланс и укрепляет сердечно-сосудистую систему. Это социальная деятельность, которой можно заниматься с друзьями и семьей. На некоторых адаптивных велосипедах можно крутить педали вручную, в то время как велосипеды-тандемы позволяют крутить педали взрослому, а ребенок с СМА едет впереди, сзади или рядом. Велосипеды могут быть оснащены электродвигателями для помощи водителю [50].
Йога – это духовная практика, призванная обеспечить гармонию между телом и разумом. Сидячая йога может помочь больным СМА укрепить мышцы, улучшить баланс, а также взгляд на жизнь посредством сопряжения дыхания и медитации. Доступные в интернете видеоролики знакомят людей с упражнениями йоги, специфичными для СМА. Присоединение к онлайн-классам адаптивной йоги или индивидуальные занятия могут быть полезными как для тела, так и для душевного здоровья и равновесия ребенка с СМА [50].
Цели двигательной реабилитации детей, которые не сидят, включают оптимизацию моторики, толерантность к различным положениям и минимизацию нарушений. Основными задачами реабилитации сидячих пациентов являются предотвращение контрактур, сохранение функций и подвижности. Главная задача мобильной реабилитации с помощью ходунков – сохранение и улучшение двигательных функций, подвижности, гибкости, равновесия и выносливости [51–53].
Важно не перенапрягаться, т.к. повреждение мышц, вызванное физическими упражнениями, может усилить мышечную слабость и атрофию. Мышцы у людей с СМА не способны легко восстановиться после травм, и они могут утомляться как физически, так и при умственной нагрузке. Переутомление приводит к проблемам с равновесием.
Для детей упражнения можно превратить в игру. Специальное оборудование, такое как адаптивный велосипед, модифицированные качели и игрушки, сделают занятия спортом более приятными для детей. Адаптивные приспособления и подтяжки можно использовать для поддержки детей во время физических упражнений.
Плавание, аэробика, скандинавская ходьба, езда на велосипеде, йога, гребля и эллиптические кросс-тренажеры, верховая езда и игры на колясках также могут быть включены в реабилитационную программу под наблюдением специалистов, поскольку содействуют тренировке одновременно всех основных мышц и вертикальному позиционированию [54][55].
Падение может привести к переломам и усугубить снижение подвижности при течении заболевания. Исследования показали связь между слабостью, утомляемостью, изменчивостью походки и падениями. Отмечено, что изменчивость длины шага – ключевая переменная, связанная с падениями. Усталость влияет на длину шага, баланс и координацию движений. Ситуации, которые могут привести к падению, включают трансферы (например, с инвалидной коляски на физиотерапевтическое или акватерапевтическое оборудование), условия низкой освещенности, слабость или некомпетентность ассистивного персонала [28][41][50].
Специалисты советуют пациентам с СМА включить физические упражнения в ежедневный график в одно и то же время суток, делать приятные упражнения, не беспокоиться о совершенстве исполнения, не расстраиваться по поводу пропуска дня тренировок, разбивать упражнения на более короткие подходы, отдыхать и не перегружать мышцы и суставы [50][52].
У больных СМА оценка физической силы и двигательной функции является прогностически актуальной. Мониторинг физического состояния пациента с СМА, его мобильности и двигательной функции следует проводить с набором разнообразных шкал [19]. При выборе шкалы важно учитывать тип СМА, возраст пациента, уровень его функционирования, ожидаемые изменения и элементы, выбираемые для оценки (табл. 2).
Таблица 2. Соответствие шкал двигательного развития
функциональному статусу пациента со спинальной мышечной атрофией
(составлено автором по данным [19])
Table 2. Correspondence of motor development scales
to the functional status of a patient with spinal muscular atrophy
(compiled by the author using data from [19])
Шкала / Scale | Не способные сидеть (тип 1) / Non-sitters (type 1) | Способные сидеть (тип 2, неамбулаторный тип 3) / Sitters (type 2, non-ambulant type 3) | Способные сидеть (амбулаторный тип 3) / Sitters (ambulant type 3) |
Двигательное развитие / Promote function | |||
Шкала оценки неврологического статуса у детей раннего возраста по Методике Королевской больницы Хаммерсмит / Hammersmith Infant Neurological Examination (HINE) [41] | + | – | – |
Функциональная шкала / Functional scale | |||
Tест у детей раннего возраста на выявление нервно-мышечных расстройств Детского госпиталя Филадельфии / Childrens’ Hospital of Philadelphia Infant Test of Neuromuscular Disorders (CHOP-INTEND) [56] | + | – | – |
Расширенная шкала оценки моторных функций больницы Хаммерсмит / Hammersmith Functional Motor Scale – Expanded (HFMSE) [57] | – | + | + |
Пересмотренный модуль оценки моторной функции верхних конечностей / Revised Upper Limb Module (RULM) [58] | – | + | + |
Оценка моторных функций / Motor Function Measure (MFM) [59][60] | – | + | – |
Измерение выносливости / Endurance measurement | |||
Тест 6-минутной ходьбы / 6 Minutes Walking Test (6MWT) [44] | – | – | + |
Правильное применение валидированных шкал позволит проанализировать текущий функциональный статус, понять динамику состояния здоровья ребенка, при необходимости проактивно скорректировать реабилитационный план.
Физиотерапия
Физиотерапия с использованием электротерапии, акватерапии, вибрационных и других методов может положительно повлиять на физический статус, качество жизни, социальную интеграцию детей с СМА.
Международный комитет по стандартам лечения СМА рекомендует пациентам с СМА 3-го типа, которые могут сидеть или ходить, акватерапию для улучшения баланса, гибкости, силы, осанки и ходьбы. Дети с диагнозом СМА 1-го типа могут заниматься деятельностью, направленной на дыхательную функцию, например гонять в воде шарики для пинг-понга. Вода обладает уникальными свойствами, которые позволяют облегчить вес и поддержать осанку, улучшить антигравитационные движения и дать ребенку возможность выполнять действия, которые могут быть за пределами их возможностей на суше [61].
Хотя водная терапия рекомендована детям с СМА, обнаружены лишь единичные исследования, в которых изучалась ее эффективность [62]. Оценивалось добавление водной терапии к традиционной физиотерапии для детей и взрослых с СМА. В исследовании приняли участие 30 детей с СМА 2-го типа в возрасте от 1 года до 10 лет и 20 детей и взрослых с СМА 3-го типа в возрасте от 6 до 40 лет. Водная терапия проводилась 2 раза в неделю в течение 2-летнего периода. Состояние участников оценивали каждые 2 мес. Выявлено улучшение мышечной силы у больных СМА 3-го типа. Авторы сообщили, что 93% пациентов с СМА 2-го типа и 100% участников с СМА 3-го типа продемонстрировали улучшение индекса Бартеля.
Описана программа водной терапии для 12-месячного ребенка с СМА 1-го типа [63]. У ребенка была сильная мышечная слабость, и ему требовалась помощь опекуна во всех функциональных действиях. Водная терапия включала активный диапазон двигательных упражнений, дыхательные упражнения и вестибулярную стимуляцию в вертикальном положении с посторонней помощью. Вестибулярная стимуляция осуществлялась за счет того, что терапевт поддерживал ребенка в положении обнимания и ходил в разных направлениях и по кругу, держа ребенка на руках. Ассистент также осторожно «подпрыгивал» ребенка вверх и вниз. Данное исследование ставило целью описание программы водной терапии с упором на спектр функциональных движений для ребенка с СМА [63].
Меры предосторожности при занятиях водными видами спорта при СМА предусматривают наличие и при необходимости применение медтехники, например аспиратора, у бассейна, а также планирование входа и выхода из воды. Хорошим вариантом может стать бассейн со вспомогательным оборудованием, например подъемником Хойера. Оптимальной является температура воды в бассейне от 32 до 35 ºС, но более энергичные упражнения можно выполнять в бассейне с температурой 30–31 ºС. При необходимости следует применить опору для шеи, а также использовать нарукавники или плавсредства для бассейна и другие приспособления, которые помогут сохранять устойчивость в воде [50].
Целью исследования С. Stark et al. было определение эффекта нового метода вибрационной нервно-мышечной реабилитации у детей с СМА 2–3-го типов [21]. Вибрация всего тела в последнее время вызвала клинический и научный интерес как эффективный, безопасный и экономичный метод улучшения нервно-мышечных взаимодействий у детей и подростков с нервно-мышечными заболеваниями. Рефлекторные сокращения мышц обеспечивают механизмы афферентной обратной связи, что может иметь потенциальную пользу для пациентов с СМА, поскольку активируются мышечные веретена, что стимулирует α-мотонейроны через афферентные волокна – следовательно, может реализоваться нейропротекторное действие. В ретроспективном обсервационном исследовании были проанализированы 38 детей (средний возраст 4,64±1,95 года). Программа физиотерапии (нем. Auf die Beine – букв. «поднимающая на ноги») сочетала 6-месячную боковую переменную вибрацию всего тела в домашних условиях с интервальными блоками интенсивной целенаправленной реабилитации: 13 дней в начале и 6 дней через 3 мес. Частота поперечной вибрации (англ. stochastic whole-body vibration, sWBV), амплитуда, угол наклона регулировались индивидуально. Дети, родители и терапевты работали над индивидуальной целью ребенка. Дополнительно добавлялись три компонента: функциональная тренировка с отягощениями, терапия в бассейне и тренировка на беговой дорожке с поддержкой веса тела или без нее. Каждый из дополнительных компонентов применялся 2–3 раза в неделю. Оценка состояния здоровья ребенка проводилась вначале (М0), через 6 мес домашнего ведения (М6) и через 6 мес последующего наблюдения (М12). Двигательные способности оценивались с помощью шкалы общей моторной функции и шкалы функциональной мобильности больницы Хаммерсмит, показатель по которой через 12 мес увеличился на 2,73±1,79 балла (р=0,007) (≥2 баллов у 8 из 11 (72,7%) детей с СМА 2–3-го типов). Однако вопрос о том, приведет ли это к долгосрочному клиническому эффекту, требует дальнейшего изучения. Для сравнения, только у 10,2% детей (5 из 49) отмечены изменения, превышающие 2 балла в этом возрасте в естественном анамнезе. Сопоставимые результаты были получены в ходе исследования нусинерсена. Группа лечения нусинерсеном показала улучшение более чем на 3 балла у 56,8% детей (р=0,226). Большинство ухудшений, о которых сообщили родители, возможно, связаны с «неконтролируемой» тренировкой между М6 и М12. Поэтому авторы рекомендуют контролируемое обучение в рамках структурированной и контролируемой концепции [21].
Управление питанием
Исследования, проведенные у детей с СМА, выявили проблемы питания, связанные с трудностями с кормлением и дефицитом питательных веществ, например жирных кислот, витаминов А, D, К, фолиевой кислоты, кальция, железа и магния [51][64–66]. В наиболее тяжелой форме СМА 1-го типа у младенцев наблюдается быстрая потеря массы скелетных мышц с выраженной общей мышечной слабостью.
Затруднения при кормлении и глотании возникают из-за прогрессирующей слабости бульбарных мышц и мышц пищевода. Дисфагия часто встречается у несидящих и сидящих детей с СМА, но редко беспокоит тех, кто ходит. Признаки, указывающие на нарушения глотания, – слабое сосание, трудности с эвакуацией содержимого из ротовой полости, срыгивания, быстрая утомляемость, влажный голос, респираторные инфекции, увеличение времени приема пищи и обильное слюнотечение. Наличие рецидивирующих пневмоний также является потенциальным индикатором аспирации [19][44].
На преоральном этапе сложности заключаются в ограниченных открывании рта и доставке пищи в рот для самостоятельного кормления. На оральном этапе к трудностям относятся слабый прикус и повышенная утомляемость жевательных мышц. Отсутствие координации акта глотания приводит к аспирации. Плохой контроль головы также может быть фактором развития нарушений кормления [67][68].
У пациентов с СМА развиваются метаболические нарушения, такие как измененный метаболизм жирных кислот, нарушение толерантности к глюкозе, дефекты мышечных митохондрий, что позволяет предположить, что потеря белка SMN влияет на синтез и метаболизм энзимов [19][69].
У детей с СМА могут наблюдаться гастроэзофагеальный рефлюкс, запор, вздутие живота. Причинами могут быть замедленная перистальтика желудка и кишечника, снижение потребления воды и продуктов, богатых клетчаткой, гипотонус мышц брюшной стенки.
Гастроэнтеролог и эксперт-диетолог должны участвовать в мониторинге массы тела и потребления жидкости, макро- и микроэлементов, особенно кальция и витамина D для здоровья костей. Диаграммы роста, характерные для СМА разных типов, пока недоступны.
Желателен сбор анамнеза кормления с наблюдением за продолжительностью приема пищи. Следует изучить историю эпизодов удушья или кашля во время кормления и контролировать их с помощью исследований глотания. Для мониторинга роста таких пациентов рекомендуется измерять продольные антропометрические размеры и контролировать массу тела.
Видеоисследование глотания (англ. video swallowing study, VSS) следует проводить после первоначальной оценки, если есть сомнения в безопасности глотания [25]. Обследование рекомендуется проводить после постановки диагноза и периодически каждые 3–6 мес для детей младшего возраста, а затем ежегодно. Целями VVS являются снижение риска аспирации при глотании, оптимизация эффективности кормления и обеспечение приятного приема пищи.
Для детей с СМА рекомендуется индивидуальная оценка и планирование питания. Обеспечение соответствующей диеты, подбор адекватной консистенции пищи и жидкости являются определяющей стратегией кормления пациента. Полутвердую диету можно использовать для компенсации плохого жевания и сокращения продолжительности приема пищи. Загустевшие жидкости могут рассматриваться как альтернатива питью, чтобы снизить риск аспирации [70].
Изменение сидения и ортопедические устройства, способствующие правильному позиционированию, могут повысить безопасность и эффективность глотания [33].
Некоторые исследователи рекомендуют раннюю гастротомию у несидящих пациентов, пока ребенок здоров, тогда как другие считают, что подвергать таких больных риску хирургического вмешательства нецелесообразно до появления симптомов дисфагии и аспирации. Кормление через гастростому является оптимальным методом, когда наблюдается снижение или недостаточный набор массы тела либо пероральное кормление сопряжено с аспирацией, в случае невозможности следовать диетическим рекомендациям, при задержке роста. Рекомендуется установка назогастрального зонда на короткий срок до тех пор, пока невозможно установить гастростомическую трубку на длительный срок.
Несмотря на отсутствие единого мнения, многие эксперты выступают за фундопликацию по Ниссену в сочетании с установкой гастростомической трубки для лечения желудочно-кишечного рефлюкса [71].
В проспективном исследовании А. Yerushalmy-Feler et al. [72] с участием детей и молодых людей (<24 лет) с СМА, которое проводилось в многопрофильной клинике в период с января 2017 г. по июль 2019 г., исходно у 28 (54,9%) пациентов отмечалась недостаточность питания, из них у 20 (71,4%) – ее тяжелая форма. Всего в исследование включен 51 пациент с СМА, средний возраст составил 7,2 года (интерквартильный размах 2,1–15,3 года). Среди них 24 (47%) пациента имели СМА 1-го типа, 16 (31,4%) – СМА 2-го типа и 11 (21,6%) – СМА 3-го типа. Целью исследования являлась оценка влияния диетического вмешательства на нутритивный статус пациентов с СМА, получавших терапию нусинерсеном. Вторичная цель состояла в изучении влияния времени диетического вмешательства в связи с терапией нусинерсеном на нутритивный статус больных. Установлено, что нусинерсен снижает частоту тяжелой недостаточности питания у пациентов с СМА 1-го типа. Увеличение бульбарной функции (например, силы укуса) после лечения нусинерсеном может способствовать улучшению результатов питания. Однако, несмотря на первоначальное улучшение после введения нусинерсена, симптомы утомления от еды и небезопасного глотания впоследствии вновь появились у пациентов с СМА 1-го типа. Нутритивный статус оценивался по потреблению калорий, жидкости, макронутриентов и микроэлементов детским гастроэнтерологом и диетологом каждые 3–4 мес или чаще, по мере необходимости. Диетическое вмешательство проводилось либо до, либо после начала терапии нусинерсеном. Вмешательство в питание было основано на консенсусном заявлении по лечению СМА [19]. Антропометрические данные документировались до и после диетического вмешательства при каждом посещении, а полная оценка питания проводилась посредством дневника питания. Индекс массы тела пациентов, которые начали терапию нусинерсеном после диетического вмешательства (первая группа), увеличился по сравнению с пациентами, которые начали терапию нусинерсеном до диетического вмешательства (вторая группа) (р=0,042). В первой группе также наблюдалось значительное увеличение общего потребления энергии и белка (р=0,043). Был сделан вывод о важности сочетания адекватного управления питанием с лечением, модифицирующим заболевание [72].
Ортезирование и ортопедия
В свете научных достижений в лечении СМА с помощью генной терапии стратегии лечения должны адаптироваться, чтобы соответствующим образом учитывать меняющийся подход к ортопедической помощи этой группе населения. Предыдущие исследования рекомендовали агрессивную фиксацию и хирургическое вмешательство для лечения быстро прогрессирующего сколиоза у детей с СМА [73][74].
Разработано экспертное консенсусное заключение, согласно которому рекомендуются конкретные стратегии лечения, стратифицированные по возрасту и основному искривлению, а также по интерпретации сопутствующих характеристик, таких как скорость прогрессирования искривления, боль, функциональные изменения и гиперкифоз [33].
Поскольку генетическая терапия становится основой лечения в этой группе населения, правильная ортопедическая терапия имеет большое значение для целей обеспечения интратекального доступа, при котором уровень поясничных позвонков остается без инструментов, что важно для манипуляций на позвоночнике.
Мониторинг состояния ребенка с СМА направлен на своевременное выявление показаний к ортезированию патологии опорной системы с целью определения ранних сроков для оказания помощи при патологии шейного, грудного и поясничного отделов позвоночника, для предупреждения возникновения и прогрессирования сколиоза, деформации грудной клетки и ортопедического лечения патологии суставов, остеопороза, контрактур и иммобилизации.
Осмотр позвоночника необходимо проводить регулярно при клиническом обследовании. При подозрении на сколиоз рентгенограммы позвоночника следует выполнять в максимально вертикальном положении, которого пациент может самостоятельно достичь. Угол Кобба можно использовать для оценки управления. Если угол Кобба меньше 15–20°, рекомендуется проявить настороженность, а если он больше 15–20°, предлагается ношение корсета, особенно у детей с отставанием роста.
Ортезы обеспечивают постуральную поддержку, уменьшая нежелательные движения и деформации. Для ретракции мышц осевого скелета и конечностей можно использовать ортезы, шины, активное или пассивное позиционирование, поэтапное гипсование. Вертикализация может быть достигнута с использованием грудопояснично-крестцовых ортезов (корсетов) (англ. thoracic-lumbar-sacral orthosis, TLSO), ортезов (шин) для колена, голеностопа и стопы (англ. knee-ankle-foot orthosis, KAFO) или отдельных устройств для тазобедренного сустава, колена, лодыжки и стопы (англ. hip-knee-ankle-foot orthosis, HKAFO). Воротник Шанта часто используют для фиксации шеи в вертикальном положении с целью снижения риска удушья и регулирования головы [75][76].
Шейный корсет применяется для поддержки головы. Ортезы грудопоясничного отдела, крестца рекомендуются для поддержания осанки и улучшения функций. Ортезы верхних и нижних конечностей используются для поддержания моторных и двигательных функций, гибкости и осанки. При СМА фиксация позвоночника улучшает контроль позы в положении сидя и поддерживает функциональность верхних конечностей. Вертикальное положение пациента следует сохранять а течение не более 60 мин, минимум 3–5 раз в неделю и максимум 5–7 раз в неделю [75][76]. Ортезы можно использовать при условии, что они не нарушают функцию легких. Корсеты TLSO с брюшным окном рекомендуются для респираторной поддержки. Спинные ортезы должны быть изготовлены с вырезом в брюшной полости, обеспечивающим соответствующую экскурсию диафрагмы и доступ для гастростомических трубок. В настоящее время нет единого мнения относительно типа используемого корсета, поскольку могут быть рекомендованы как жесткие, так и мягкие ортезы для грудопоясничного отдела позвоночника. Ортезы верхних конечностей включают использование мобильных опор для рук и кистей, которые увеличивают диапазон движений и функциональные способности.
У пациентов с достаточной силой следует рассмотреть возможность применения тазобедренных ортезов, коленно-голеностопных ортопедических стелек и ортопедических стелек для ходьбы и стояния или передвижения с помощью ходунков. Если это невозможно, есть вариант вертикальной рамы или мобильного штатива с ортезами голеностопного сустава. Ортопедические стельки следует носить не менее 5 раз в неделю и снимать за 60 мин до сна. У детей с СМА 2-го типа существует корреляция между достижением ходьбы с помощью ортопедических стелек и корсетов и снижением риска развития сколиоза [77].
Симптоматическая фармакотерапия
Симптоматическое лечение является важным дополнением к патогенетической терапии СМА, поскольку жизненно необходима таким пациентам. Рассматриваемая в данном разделе симптоматическая терапия имеет уровень убедительности рекомендаций C [78].
Для коррекции снижения минеральной плотности костной ткани (МПКТ) рекомендован прием кальция глюконата и колекальциферола всем пациентам с СМА, если выявлены признаки остеопении или низкая концентрация витамина D в крови [18][78]. Если обнаружена остеопения или отмечены частые переломы, для коррекции снижения МПКТ предлагается прием бисфосфонатов [19], однако доказательства пользы ограничены.
При гастроэзофагеальном рефлюксе может быть показан прием ингибиторов протонного насоса – омепразола или эзомепразола [20].
При выявлении бронхоспазма для его снятия рекомендована небулайзерная терапия бронходилатирующим комбинированным средством – «β2-адреномиметик селективный + м-холиноблокатор» [20][78]. Муколитики использовать нежелательно в связи с риском усиления секреторной нагрузки. Также применение гипертонического раствора натрия хлорида может привести к разжижению секрета нормальной вязкости и усилению секреторной нагрузки.
Пациентам с СМА не рекомендуется эмпирический прием антибиотиков для предотвращения инфекционных осложнений без наличия особых показаний к антибактериальной терапии [79]. В то же время у больных СМА 1-го типа, а также часто болеющих пациентов с другими типами CМА и очагами хронической инфекции раннее начало антибиотикотерапии при инфекционных заболеваниях имеет принципиальное значение.
Рекомендуются инъекции ботулинического токсина типа А в слюнные железы пациентам с СМА, страдающим гиперсаливацией, с целью уменьшения степени выраженности этого симптома [80]. Больным с гиперсаливацией также показана санация полости рта.
Появление патогенетического лечения СМА (нусинурсен) дает надежду на лучший прогноз данного заболевания. Как в случае любой фармакотерапии, возможно возникновение побочных явлений: гиперчувствительность, менингит, боль в спине, головная боль [16]. Родителей может беспокоить сопутствующее применение седативных препаратов. Рисдиплам разрешен для детей в возрасте 2 мес и старше, принимается внутрь после еды каждый день. Из нежелательных явлений рисдиплам может вызвать диарею, сыпь, васкулит [18].
При появлении побочного действия лекарственных препаратов патогенетической терапии необходимо провести симптоматическое лечение, руководствуясь клиническими симптомами и стандартами оказания медицинской помощи или клиническими рекомендациями.
Техническая мобильность
Дети от природы любопытны и хотят иметь возможность исследовать окружающий мир. Самостоятельное передвижение у них связано с развитием эмоциональных навыков, пространственного познания, независимости и взаимодействия с социальным и природным окружением, появлением новых адаптивных способностей и чувством причастности к миру [4].
У всех пациентов подбор подходящих средств передвижения, вспомогательного оборудования, ассистивных технологий и адаптации к окружающей среде позволит достичь приемлемого уровня вовлеченности в жизнь социума. Адаптивное оборудование улучшает мобильность, повседневную активность и качество жизни детей с СМА.
У тех, кто не сидит, поза пациента должна определять выбор оборудования и устройств, улучшающих общую функцию. Игровая и профессиональная поддержка должна включать легкие игрушки и вспомогательные технологии с регулируемым управлением и различными системами активации. У всех пациентов оборудование, связанное с повседневной деятельностью, и вспомогательные технологии могут быть полезны для улучшения способностей к самостоятельной работе и игре. Необходимо изучить возможность экологического контроля и модификаций дома, чтобы обеспечить безопасную доступность и максимальную независимость [25].
Рекомендуется применять индивидуальные инвалидные коляски. Инвалидные коляски с опускающейся/наклоняющейся спинкой, индивидуальными сиденьями и шейными фиксаторами можно использовать для ежедневного передвижения и транзита. Легкие инвалидные коляски с ручным управлением или электроприводом для облегчения самостоятельного передвижения идеально подходят для обеспечения мобильности больных СМА и их функциональной независимости и могут быть рекомендованы пациентам с сохраненной функцией верхних конечностей и мышечной силой. Инвалидные коляски с электроприводом или мотороллеры можно использовать для преодоления больших расстояний. Все пациенты с СМА 1–2-го типов должны иметь инвалидные коляски со специальной постуральной поддержкой и сиденьем. Использование моторизованной инвалидной коляски следует оценивать у больных старше 2 лет [38][40]. Инвалидные коляски могут быть оснащены критически важным медицинским оборудованием и иметь настраиваемое управление [13][42][50].
Стенды, ходунки, инвалидные коляски и подтяжки позволяют детям стоять и передвигаться в зависимости от выносливости и мышечной силы. Рекомендуется использовать инвалидную коляску, изготовленную по индивидуальному заказу, с возможностью наклона и адаптированными системами сидения. Решение о применении инвалидной коляски зависит от нескольких факторов, а именно от падений пациента и усталости. Если ребенок слишком слаб, чтобы самостоятельно передвигаться, или быстро утомляется, работая на стуле, следует порекомендовать электрическое кресло [19].
Технологический и эргометрический менеджмент
Тренировка ходьбы с помощью робота (англ. robotic assisted gait training, RAGT) – это физиотерапевтический подход, который сочетает в себе робототехнику и интенсивные повторяющиеся тренировки для повышения мобильности, однако недостаточно доказательств, подтверждающих его эффективность у пациентов с СМА.
Гибридная вспомогательная конечность (англ. hybrid assistive limp, HAL) – лечебное устройство, использующее кибернику для облегчения упражнений при ходьбе и доказавшее свою эффективность по сравнению с традиционной ходьбой у пациентов с неизлечимыми нервно-мышечными заболеваниями [81]. Технология киберники объединяет нервную систему человека и робота с помощью биоэлектрических сигналов. Это приводит к динамическому состоянию, в котором пользователь и устройство физически и функционально связаны, а устройство работает на основе двигательных намерений пользователя и внутренних идеальных моделей движений [82]. Использование устройства HAL привело к значительному улучшению пройденного расстояния во время 2-минутного теста ходьбы и общих показателей частоты вращения педалей в течение 10-минутного велоэргометрического теста. Сообщалось о легких побочных эффектах, таких как миалгия, боль в спине и проблемы контакта с кожей, которые легко разрешились [83].
Yumen Arm (Yumen Green Field Biological Production Co., Ltd, Китай) – это новая динамическая опора для рук, которая может улучшить выполнение задач на верхних конечностях у пациентов с нервно-мышечными заболеваниями. Исследования показывают, что использование Yumen Arm может привести к улучшению активного диапазона движений и функциональных способностей, а также сделать упражнения менее утомительными. Однако индивидуальная вариабельность пациентов высока, что подчеркивает важность адаптации динамических опор для рук к конкретным потребностям каждого [4][84]. Новый подход к оценке функции верхних конечностей у больных СМА был создан с помощью сенсора Kinect 3-D. Датчик портативен и экономичен, а оценка выполнена в виде игрового теста. На основе Kinect проводится комплексный и объективный анализ движений, причем это недорогое, портативное и удобное для детей решение по сравнению с традиционными клиническими оценочными шкалами или видеосистемами на базе маркеров. Использование динамических опор для рук облегчает движение конечностей против силы тяжести и помогает выполнять важные задачи, такие как прием пищи и жидкости, тактильные контакты [85]. Исследования показали, что большинство пользователей удовлетворены динамическими опорами для рук. Однако сообщается, что при непрерывном их применении до 17 ч в день большинство со временем от них отказывается. Эксперты полагают, что прогрессирование заболевания затрудняет использование таких опор [85].
Роботизированный экзоскелет Wilmington (англ. Wilmington Robotic Exoskeleton, WREX) (JAECO Orthopedic Specialties Inc., США) представляет собой модульный ортез с приводом от тела, который можно легко прикрепить к инвалидной коляске, чтобы обеспечить антигравитационные трехмерные движения рук. Пациенты, использующие WREX, и члены их семей сообщили об улучшении самостоятельных двигательных функций. Однако текущая версия аппарата не способствует пронации или супинации, которые необходимы для процесса самостоятельного питания, и эта дополнительная степень гибкости планируется для будущей версии WREX [86].
Зоотерапия
Зоотерапия, или анималотерапия (от лат. animal – животное и греч. θεραπεία – лечение), – вид терапии, использующий животных, а также их звуки и символы для лечения, реабилитации и профилактики заболеваний, оказания психотерапевтической помощи.
Зоотерапия является методом коррекционной работы, важным для психологического сопровождения семей, воспитывающих детей с нарушениями или выраженными проблемами здоровья. Терапевтический эффект, выявленный в конце XIX века в английской психиатрической больнице Йорк-Ретрит, достигался просто: пациенты ухаживали за собаками, кошками, кроликами и голубями, еще более слабыми, чем они сами, и чувствовали прилив моральных сил [87]. Целями зоотерапии являются достижение психологического комфорта, познавательное и сенсорное развитие ребенка, стимулирование чувства любви и положительных эмоций.
Описана иппотерапия как метод реабилитации детей с церебральным параличом и синдромом Дауна. Американская ассоциация иппотерапии (англ. American Hippotherapy Association, AHA) определяет иппотерапию как программу динамического вмешательства, использующую многомерные характеристики лошади [88]. Лошадь служит опорой, обеспечивая при этом повторяющиеся, ритмичные и переменные движения. Опыт работы с лошадьми предлагает навыки сенсорной интеграции посредством тактильных, вестибулярных и проприоцептивных сенсорных вмешательств.
Целью исследования D. Lemke et al. было определить физическое и психосоциальное влияние занятий и терапии с использованием лошадей (англ. equine assisted activities and therapies, EAAT) на детей с СМА с точки зрения ребенка и его родителей [89]. EAAT, включающая адаптивную езду/иппотерапию, отличается от развлекательной и спортивной езды, поскольку основная задача EAAT состоит в достижении терапевтического эффекта [54][90]. Результаты исследования продемонстрировали, что общий опыт EAAT был источником удовольствия, уверенности в себе и причастности к здоровой жизни для детей с СМА. Сеансы иппотерапии улучшили координацию, время реакции, внимание и контроль дыхания.
Растет интерес к использованию специально обученных служебных собак для помощи пациентам с СМА в повседневной деятельности [91]. В целом служебные собаки, вероятно, более полезны для людей с СМА 3–4-го типов, хотя некоторые пациенты с СМА 2-го типа также смогут взаимодействовать с ними. Спокойное, умное, поддающееся тренировке животное может быть помощником ребенку с СМА [92].
Если человек пользуется инвалидной коляской, испытывает мышечную слабость или трудности с передвижением, служебная собака помогает найти и принести определенные предметы по команде [93]. Собака-компаньон может помочь при психических расстройствах, таких как депрессия и тревога, которые сопровождают СМА. Взаимодействие с животным уменьшает беспокойство, дает эмоциональную поддержку, тем самым снижая стресс, а также снимая возможные психосоматические проявления [55][94]. Обученные служебные собаки помогают людям в инвалидной коляске перемещаться по пандусу или тротуару. Собаку также можно научить помогать человеку садиться в инвалидную коляску и выходить из нее, открывать или закрывать двери, выключать и включать свет, приносить лекарства. Наличие помощника, который будет выполнять хотя бы единичные задачи, приносит радость и облегчает ежедневную нагрузку людям с проблемами подвижности или моторики. Если больному СМА требуется медицинская помощь, собака может громко залаять или иным образом привлечь внимание людей поблизости, благодаря чему человек получит необходимую поддержку [92–95].
Общение с животным – это психологический и эмоциональный контакт как элемент полноценной вовлеченности в социальную среду, дающий чувство защиты и поддержки. Пациенты с СМА могут чувствовать себя более сильными, независимыми и уверенными в повседневной жизни, коммуницируя с животными. Все эти факторы можно объединить и расценивать как меры медицинской реабилитации, способствующие улучшению качества жизни человека с диагнозом СМА.
Хирургическое вмешательство на позвоночнике и суставах
Более чем у половины детей с СМА развивается сколиоз, который чаще всего наблюдается у тех, кто не передвигается или потерял способность ходить. Гипотонические искривления позвоночника и грудной кифоз могут прогрессировать в детстве. Примерно у 50% пациентов с СМА 3-го типа развивается сколиоз, им страдают почти все дети с СМА 1–2-го типов. Если сколиоз не лечить, он может ухудшить прогноз для дыхательной системы, вызывая рестриктивное заболевание легких [22].
Исследование с участием 34 детей (18 с СМА и 16 с мышечной болезнью Дюшенна) показало, что снижение ФЖЕЛ варьировалось в зависимости от возрастной группы, а также присутствия сколиоза. Значительному числу пациентов потребовалось хирургическое вмешательство по поводу сколиоза. Показатели ФЖЕЛ коррелировали с оценками по шкале оценки моторных функций больницы Хаммерсмит (англ. Hammersmith Functional Motor Scale, HFMS) и пересмотренному модулю оценки моторной функции верхних конечностей (англ. Revised Upper Limb Module, RULM), а НИВЛ с положительным давлением была эффективна в управлении дыхательной функцией у пациентов с СМА, перенесших операцию на позвоночнике [96].
Основные 16 вопросов, связанных с хирургическим вмешательством у пациентам с СМА, были вынесены на рассмотрение экспертным советом Общества по лечению сколиоза в 2015 г. [97]. По итогу обсуждения опыта ведения и практик лечения СМА сформулировано заявление экспертного консенсуса, которым следует руководствоваться при оказании хирургической помощи пациентам с СМА. Всего учитывалось мнение 11 ведущих экспертов – 7 из Центральной Америки и 4 из Евросоюза (табл. 3).
Таблица 3. Соглашение по пунктам,
описывающим лечение спинальной мышечной атрофии (СМА)
(достижение консенсуса при >70% за или против) [97]
Table 3. Agreement with items describing the treatment of spinal muscular atrophy (SMA)
(reaching consensus with >70% in favor or against) [97]
Пункты, описывающие лечение СМА / Items describing SMA treatment | n/N (%) |
При деформации позвоночника / In spinal deformity | |
Ортопедическая фиксация позвоночника при деформации позвоночника у пациентов с незрелым скелетом и большим углом искривления составляет 15–50° / There is a role for orthotic bracing of spine deformity in skeletally immature patients with major curve angle between 15–50° | 9/11 (82) |
Спинальные инструменты на позвоночнике следует применять у пациентов с углом искривления более 50° / Spine instrumentation should be implemented in patients with major curve angle greater than 50° | 10/11 (91) |
Инструменты GF следует использовать у пациентов с незрелым скелетом, у которых угол искривления позвоночника превышает 50° / GF instrumentation should be used in skeletally immature patients with major curve angle greater than 50° | 10/11 (91) |
При большой прогрессирующей кривой инструментарий GF подходит в возрасте от 4 до 8 лет / In the setting of a large, progressive curve, GF instrumentation is appropriate at ages 4 through 8 years | 10/11 (91) |
PSF следует использовать у пациентов со зрелым скелетом и большим углом искривления более 50° / PSF should be used in skeletally mature patients with major curve angle greater than 50° | 10/11 (91) |
При большом прогрессирующем искривлении PSF подходит в возрасте ≥12 лет / In the setting of a large, progressive curve, PSF is appropriate at ages greater than or equal to 12 years | 10/11 (91) |
Для детей с искривлением более 50° в возрасте от 8 до 12 лет инструментарий зависит от зрелости скелета и клинических обоснований / For children with curves greater than 50°, between 8 and 12 years old, instrumentation depends on skeletal maturity and clinical reasoning | 10/11 (91) |
Прогрессирование искривления является основным фактором при принятии хирургического решения у пациентов с незрелым скелетом и зрелых пациентов / Curve progression is a major factor in surgical decision making in skeletally immature patients and mature patients | 10/11 (91) 9/11 (82) |
Прогрессирование искривления, снижение дыхательной функции, неблагоприятное влияние на функцию, перекос таза, дисбаланс туловища и деформация ребер в виде «сложенного зонта» способствуют принятию решения о применении спинальных инструментов / Curve progression, decreasing respiratory function, adverse effect on function, pelvic obliquity, trunk imbalance, and rib parasol encourage the decision to implement spinal instrumentation | 8/11–10/11 (73–91) |
Функциональные тесты легких (например, объем формированного выдоха за 1 с, форсированная жизненная емкость легкого) являются важными оценочными тестами для пациентов, перенесших операцию по поводу сколиоза / Pulmonary function tests (e.g., forced expiratory volume in 1 sec, forced vital lung capacity) are important evaluation tests for patients undergoing surgery for scoliosis | 9/11 (82) |
MCGRs следует использовать в качестве альтернативы традиционным растущим стержням у пациентов с СМА с незрелым скелетом, чтобы уменьшить необходимость повторного хирургического вмешательства / MCGRs should be used as an alternative to traditional growing rods in skeletally immature patients with SMA in order to decrease the need for repeated surgery | 10/11 (91) |
По достижении зрелости скелета инструменты GF должны быть преобразованы в PSF в каждом конкретном случае / At skeletal maturity, GF instrumentation should be converted to PSF on a case-by-case basis | 10/11 (91) |
Определенные сегменты позвоночника следует оставлять неслитыми/нетрансплантированными в конструкциях спинальных инструментов для обеспечения интратекального доступа // Certain levels should be left unfused/ungrafted in spinal instrumentation constructs to accommodate intrathecal access | 9/11 (82) |
При нестабильности тазобедренного сустава / In hip instability | |
Одностороннюю и двустороннюю нестабильность бедра следует лечить хирургическим путем в случае значительной боли или нарушения функции / Unilateral and bilateral hip instability should be surgically managed in cases of significant pain or impaired function | 9/11 (82) |
Лечение контрактур при СМА / Contractures treatment in SMA | |
Контрактуры нижних конечностей следует лечить хирургическим путем, если они вызывают боль или нарушают функцию / Contractures of the lower extremity should be surgically managed when they cause pain or impair function | 8/11– 11/11 (73–100) |
Контрактуры верхних конечностей следует лечить хирургическим путем, если они нарушают функцию / Contractures of the upper extremity should be surgically managed when they impair function | 8/11 (73) |
Примечание. GF (англ. growth-friendly) – для растущих систем;
PSF (англ. posterior spinal fusion) – задний спондилодез;
MCGRs (англ. magnetically controlled growing rods) –
магнитно-управляемые растущие стержни;
N – общее количество ведущих экспертов экспертного совета
Общества по лечению сколиоза (N=11; 100%);
n – количество экспертов, достигших консенсуса (>70%),
рассчитывается процентное количество экспертов с единым мнением
от общего количества экспертов экспертного совета.
Note. GF – growth-friendly; PSF – posterior spinal fusion;
MCGRs – magnetically controlled growing rods;
N – the total number of leading experts in the expert council
of the Society for the Treatment of Scoliosis (N=11; 100%);
n – the number of experts who reached consensus (>70%),
the percentage of the number of experts with a common opinion
to the total number of experts in the expert council was calculated.
Тактика ведения пациентов с СМА подвергается ревизии в свете функционального улучшения у детей, получающих модифицирующую медикаментозную терапию (нусинерсен, 2016 г.). Например, исторические данные не поддерживали хирургическое лечение патологии тазобедренного сустава при СМА (высокая вероятность рецидива из-за прогрессирующей гипотонии). Тем не менее внушающий оптимизм новый метод патогенетического лечения СМА ставит под сомнение целесообразность от его отказа при оптимизации двигательных функций пациентов, повышении мышечной силы и выносливости [97].
Эмоциональная, образовательная, психологическая и социальная поддержка семьи / Emotional, educational, psychological and social family support
Поскольку заболевание неизлечимо и может прогрессировать, необходимо оценить качество жизни пациента и нагрузку на человека, осуществляющего уход. Для оценки качества жизни может применяться опросник качества жизни у детей (англ. Pediatric Quality of Life (PedsQL) Neuromuscular Module Version 3 Child) [1]. Его заполняют как дети, так и родители. Раздел для родителей содержит оценку клинического состояния ребенка с СМА, проблем с ежедневной занятостью и свободным временем, общением, обучением ребенка, финансовых трудностей и т.д. Раздел для детей включает только оценку клинических проявлений, например затруднения дыхания, приема пищи, общения, движения и болевых ощущений.
Для родителей ребенка с СМА важны уверенность врача в осуществляемой лечебной тактике, а также чувство, что их точка зрения учитывается при принятии тех или иных стратегически значимых решений. Родителей беспокоят сложные вопросы, касающиеся лечения и ухода за ребенком, например количество назначаемых седативных препаратов, сопутствующих проведению патогенетического лечения (нусинерсен для интратекального введения), наложение гастростомы, применение НИВЛ и ИВЛ, хирургическая фиксация позвоночника, регулярное выполнение физических упражнений, аспирация пищи и жидкости в дыхательные пути при кормлении и т.д. Многие родители испытывают колебания в принятии ежедневных решений и находятся в состоянии стресса и депрессии.
Меры психологической, эмоциональной и социальной реабилитации семьи должны предусматривать и предлагать самые разные методы с учетом предпочтений и интересов: трудотерапия, арт-терапия, креативные практики искусства и дизайна, речевая терапия, вокалотерапия [12][55][98].
Всей команде, осуществляющей ведение ребенка с СМА, важно своевременно обмениваться информацией о состоянии его здоровья, иметь четкий план мониторинга и контроля за всеми важными функциями организма и физическими, психологическими, социальными, образовательными и эмоциональными аспектами жизни ребенка. Для лиц, осуществляющих уход, важно постоянное обучение, понимание процессов развития ситуации и следование долговременному выверенному плану реабилитации. Семьям с ребенком, больным СМА, должна быть оказана поддержка со стороны профессиональной лечебной команды, социально-психологических служб и государства. Такие семьи не должны чувствовать себя одинокими. Требуется управленческая работа по привлечению фондов и государственного финансирования для разрешения их проблем. Следует отметить, что для пациентов с СМА чрезвычайно важно установить инвалидность, т.к. наличие статуса инвалида является основанием для льготного лекарственного обеспечения, в т.ч. патогенетического лечения. У пациентов-детей дополнительным основанием для льготного лекарственного обеспечения служит возраст до 3 лет [98]. Для благополучия лечебного процесса важны открытость, информированность, комплексная структурированная программа реабилитации, которые позволят поддержать надежды родителей на сохранение здоровья ребенка и уверенность в том, что он обретет самостоятельность, независимость, будет активно вовлечен в жизнь общества.
Поскольку СМА является генетическим заболеванием, генетическое консультирование пациентов и членов их семей важно для принятия обоснованных решений в будущем. Необходимо разъяснить пострадавшим семьям аутосомно-рецессивные модели наследования СМА. Заболевшим лицам следует предложить консультирование перед зачатием и скрининг планируемого репродуктивного партнера [99]. Американская коллегия медицинской генетики и геномики (англ. American College of Medical Genetics and Genomics, ACMG) рекомендует предлагать тестирование на носительство всем парам, независимо от расы или этнической принадлежности, а Американская коллегия акушеров и гинекологов (англ. American College of Obstetricians and Gynecologists, ACOG) – скрининг на СМА всем женщинам, которые планируют беременность или уже беременны [100].
ЗАКЛЮЧЕНИЕ / CONCLUSION
В обзоре представлены методы реабилитации детей с СМА 1–3-го типов. Учитывая тяжесть заболевания и необходимость постоянного контроля за состоянием здоровья ребенка, его психическим и эмоциональным статусом, предлагается мультидисциплинарный подход и мониторинг, которые должны осуществляться профессиональной командой, состоящей из специалистов в разных областях медицины и практических сферах психологии, психиатрии, социологии.
Ведение детей с СМА должно проводиться в соответствии со структурированной реабилитационной программой и строиться на индивидуальной основе для каждого ребенка.
Появление терапии, модифицирующей течение заболевания, внушает оптимизм и надежды на лучший прогноз, улучшение качества жизни, повышение мобильности, выносливости и физической силы у детей с СМА, а также диктует необходимость ревизии существующей парадигмы СМА и имплементации более активных реабилитационных практик (физических упражнений, физиотерапии, ортопедического лечения, хирургического вмешательства и иных методов лечения).
Необходимо проведение клинических исследований высокого уровня доказательности в данной области.
Список литературы
1. Prananta M.S., Rahmawati M.M., Goesasi R.Z. Habilitation of child with spinal muscular atrophy type 2: a case report. SPMRJ. 2022; 4 (2): 81–9. https://doi.org/10.20473/spmrj.v4i2.27554.
2. Lunn M.R., Wang C.H. Spinal muscular atrophy. Lancet. 2008; 371 (9630): 2120–33. https://doi.org/10.1016/S0140-6736(08)60921-6.
3. Kolb S.J., Kissel J.T. Spinal muscular atrophy. Neurol Clin. 2015; 33 (4): 831–46. https://doi.org/10.1016/j.ncl.2015.07.004.
4. Agyenkwa S.K., Cibooğlu P., Jhar N., et al. Rehabilitation in spinal muscular atrophy: a narrative review. Eur J Ther. 2023; 29 (3): 656–66. https://doi.org/10.58600/eurjther1516.
5. Verhaart I.E., Robertson A., Wilson I.J., et al. Prevalence, incidence and carrier frequency of 5q-linked spinal muscular atrophy – a literature review. Orphanet J Rare Dis. 2017; 12 (1): 124. https://doi.org/10.1186/s13023-017-0671-8.
6. Michelson D., Ciafaloni E., Ashwal S., et al. Evidence in focus: nusinersen use in spinal muscular atrophy: report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2018; 91 (20): 923–33. https://doi.org/10.1212/wnl.0000000000006502.
7. Bora G., Yeşbek-Kaymaz A.Y., Bekircan-Kurt C.E., et al. Recent therapeutic developments in spinal muscular atrophy. Turk J Med Sci. 2018; 48 (2): 203–11. https://doi.org/10.3906/sag-1712-1.
8. Ekici B., Bozkurt B., Tatlı B., et al. Demographic characteristics of SMA type 1 patients at a Tertiary Center in Turkey. Eur J Pediatr. 2012; 171 (3): 549–52. https://doi.org/10.1007/s00431-011-1607-2.
9. Перечень редких (орфанных) заболеваний. Министерство здравоохранения Российской Федерации, 31 мая 2024 г. URL: https://minzdrav.gov.ru/documents/9774-perechen-redkihorfannyh-zabolevaniy (дата обращения 02.06.2024).
10. Постановление Правительства РФ от 26.11.2018 № 1416 «О порядке организации обеспечения лекарственными препаратами лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, гемолитико-уремическим синдромом, юношеским артритом с системным началом, мукополисахаридозом I, II и VI типов, апластической анемией неуточненной, наследственным дефицитом факторов II (фибриногена), VII (лабильного), X (Стюарта–Прауэра), лиц после трансплантации органов и (или) тканей, а также о признании утратившими силу некоторых актов Правительства Российской Федерации». URL: https://www.consultant.ru/document/cons_doc_LAW_311869/92d969e26a4326c5d02fa79b8f9cf4994ee5633b/ (дата обращения 15.05.2024).
11. Постановление Правительства РФ от 26.04.2012 № 403 «О порядке ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента» (вместе с «Правилами ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента». URL: https://www.consultant.ru/document/cons_doc_LAW_129078/ (дата обращения 15.05.2024).
12. Araújo R.L., Melo B.C.F., Ribeiro A.M.S., et al. Rehabilitation approach to spinal muscular atrophy. Pediatr Oncall J. 2023; 20: 37–43. https://doi.org/10.7199/ped.oncall.2023.21.
13. Ross L.F., Kwon J.M. Spinal muscular atrophy: past, present, and future. NEOREVIEWS. 2019; 20 (8): e437–51. https://doi.org/10.1542/neo.20-8-e437.
14. Gidaro T., Servais L. Nusinersen treatment of spinal muscular atrophy: current knowledge and existing gaps. DEV Med Child Neurol. 2019; 61 (1): 19–24. https://doi.org/10.1111/dmcn.14027.
15. Paik J. Risdiplam: a review in spinal muscular atrophy. CNS Drugs. 2022; 36 (4): 401–10. https://doi.org/10.1007/s40263-022-00910-8.
16. Инструкция по медицинскому применению лекарственного препарата Спинраза®. Государственный реестр лекарственных средств. URL: https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=16258c22-7fdc-4e09-ace7-5059d7037971 (дата обращения 12.05.2024).
17. Инструкция по медицинскому применению лекарственного препарата Золгенсма®. Государственный реестр лекарственных средств. URL: https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=7d57ab06-e2f1-4148-8a4e-5c1928ee6d99 (дата обращения 12.05.2024).
18. Инструкция по медицинскому применению лекарственного препарата Эврисди®. Государственный реестр лекарственных средств. URL: https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=914f5329-4619-411d-952b-1e5f05b91243 (дата обращения 12.05.2024).
19. Mercuri E., Finkel R.S., Muntoni F., et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018; 28 (2): 103–15. https://doi.org/10.1016/j.nmd.2017.11.005.
20. Finkel R.S., Mercuri E., Meyer O.H., et al. Diagnosis and management of spinal muscular atrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018; 28 (3): 197–207. https://doi.org/10.1016/j.nmd.2017.11.004.
21. Stark C., Duran I., Cirak S., et al. Vibration-assisted home training program for children with spinal muscular atrophy. Child Neurology Open. 2018; 5 (11): 2329048X1878047. https://doi.org/10.1177/2329048X18780477.
22. Foead A., Yeo W.Y., Vishnumukkala T., Larvin M. Rehabilitation in spinal muscular atrophy. J Int Soc Phys Rehabil Med. 2019; 2 (1): 62–70. https://doi.org/10.4103/jisprm.jisprm_4_19.
23. Townsend E.L., Simeone S.D., Krosschell K.J., et al. Stander use in spinal muscular atrophy: results from a large natural history database. Pediatr Phys Ther. 2020; 32 (3): 235–41. https://doi.org/10.1097/PEP.0000000000000713.
24. Manzur A.Y., Muntoni F., Simonds A. Muscular dystrophy campaign sponsored workshop: recommendation for respiratory care of children with spinal muscular atrophy type II and III. 13th February 2002, London, UK. Neuromuscul Disord. 2003; 13 (2): 184–9. https://doi.org/10.1016/s0960-8966(02)00212-2.
25. Wang C.H., Finkel R.S., Bertini E.S., et al. Consensus statement for standard of care in spinal muscular atrophy. J Child Neurol. 2007; 22 (8): 1027–49. https://doi.org/10.1177/0883073807305788.
26. Fauroux B., Griffon L., Amaddeo A., et al. Respiratory management of children with spinal muscular atrophy (SMA). Arch Pediatr. 2020; 27 (7S): 7S29–34. https://doi.org/10.1016/s0929-693x(20)30274-8.
27. A guide to the 2017 international standards of care for SMA. URL: https://www.treatsma.uk/wp-content/uploads/2019/07/A-Guide-to-the-2017-International-Standards-ofCare-for-SMA.pdf (дата обращения 14.05.2024).
28. Yi Y.G., Shin H.I., Jang D.H. Rehabilitation of spinal muscular atrophy: current consensus and future direction. J Genet Med. 2020; 17 (2): 55–61. https://doi.org/10.5734/JGM.2020.17.2.55.
29. Trucco F., Ridout D., Scoto M., et al. Respiratory trajectories in type 2 and 3 spinal muscular atrophy in the iSMAC cohort study. Neurology. 2021; 96 (4): 587–99. https://doi.org/10.1212/wnl.0000000000011051.
30. Physical therapy guide to spinal muscular atrophy. URL: https://www.myactionpt.com/physical-therapy-guide-to-spinal-muscularatrophy (дата обращения 14.05.2024).
31. Skandar K., Sunartini., Nugrahanto A.P., et al. Use of air stacking to improve pulmonary function in Indonesian Duchenne muscular dystrophy patients: bridging the standard of care gap in low middle income country setting. BMC Proc. 2019; 13 (Suppl. 11): 21. https://doi.org/10.1186/s12919-019-0179-4.
32. Lim H., Oh M., Chung Y.H., et al. Effects of continuous positive airway pressure in patients at high risk of obstructive sleep apnea during propofol sedation after spinal anesthesia. J Clin Monit Comput. 2019; 33 (4): 657–63. https://doi.org/10.1007/s10877-018-0202-8.
33. Wang C.H., Finkel R.S., Bertini E.S., et al. Consensus statement for standard of care in spinal muscular atrophy. J Child Neurol. 2007; 22 (8): 1027–49. https://doi.org/10.1177/0883073807305788.
34. Schroth M.K. Special considerations in the respiratory management of spinal muscular atrophy. Pediatrics. 2009; 123 (Suppl. 4): S245–9. https://doi.org/10.1542/peds.2008-2952K.
35. Pera M.C., Romeo D.M., Graziano A., et al. Sleep disorders in spinal muscular atrophy. Sleep Medicine. 2017; 30: 160–3. https://doi.org/10.1016/j.sleep.2016.11.012.
36. Kapur N., Deegan S., Parakh A., Gauld L. Relationship between respiratory function and need for NIV in childhood SMA. Pediatr Pulmonol. 2019; 54 (11): 1774–80. https://doi.org/10.1002/ppul.24455.
37. Sansone V.A., Racca F., Ottonello G., et al. 1st Italian SMA Family Association Consensus Meeting: management and recommendations for respiratory involvement in spinal muscular atrophy (SMA) types I–III, Rome, Italy, 30–31 January 2015. Neuromuscul Disord. 2015; 25 (12): 979–89. https://doi.org/10.1016/j.nmd.2015.09.009.
38. Sheikh A.M., Vissing J. Exercise therapy for muscle and lower motor neuron diseases. Acta Myol. 2019; 38 (4): 215–32.
39. Fujak A., Raab W., Schuh A., et al. Operative treatment of scoliosis in proximal spinal muscular atrophy: results of 41 patients. Arch Orthop Trauma Surg. 2012; 132 (12): 1697–706. https://doi.org/10.1007/s00402-012-1610-8.
40. Mirea A., Leanca M.C., Onose G., et al. Physical therapy and nusinersen impact on spinal muscular atrophy rehabilitative outcome. Front Biosci. 2022; 27 (6): 179. https://doi.org/10.31083/j.fbl2706179.
41. Rathore F.A., Afridi A. Does physical exercise training improve functional performance in type 3 spinal muscular atrophy? A Cochrane review summary with commentary. DEV Med Child Neurol. 2020; 62 (9): 1014–6. https://doi.org/10.1111/dmcn.14622.
42. Trenkle J., Brugman J., Peterson A., et al. Filling the gaps in knowledge translation: physical therapy recommendations for individuals with spinal muscular atrophy compared to standard of care guidelines Neuromuscul Disord. 2021; 31 (5): 397–408. https://doi.org/10.1016/j.nmd.2021.02.011.
43. Singh S., Khan S., Singh D., et al. The uses of overnight pulse oximetry. Lung India. 2020; 37: 151–7. https://doi.org/10.4103/lungindia.lungindia_302_19.
44. Montes J., Garber C.E., Kramer S.S., et al. Single-blind, randomized, controlled clinical trial of exercise in ambulatory spinal muscular atrophy: why are the results negative? J Neuromuscul Dis. 2015; 2 (4): 463–70. https://doi.org/10.3233/JND-150101.
45. Merlini L., Bertini E., Minetti C., et al. Motor function-muscle strength relationship in spinal muscular atrophy. Muscle NERVE. 2004; 29 (4): 548–52. https://doi.org/10.1002/mus.20018.
46. Cancès C., Richelme C., Barnerias C., Espil C. Clinical features of spinal muscular atrophy (SMA) type 2. Arch Pediatr. 2020; 27 (7S): 7S18–22. https://doi.org/10.1016/S0929-693X(20)30272-4.
47. Aitkens S.G., McCrory M.A., Kilmer D.D., Bernauer E.M. Moderate resistance exercise program: its effect in slowly progressive neuromuscular disease. Arch Phys Med Rehabil. 1993; 74 (7): 711–5. https://doi.org/10.1016/0003-9993(93)90031-5.
48. Lewelt A., Krosschell K.J., Stoddard G.J., et al. Resistance strength training exercise in children with spinal muscular atrophy. Muscle NERVE. 2015; 52 (4): 559–67. https://doi.org/10.1002/mus.24568.
49. Madsen K.L., Hansen R.S., Preisler N., et al. Training improves oxidative capacity, but not function, in spinal muscular atrophy type III. Muscle NERVE. 2015; 52 (2): 240–4. https://doi.org/10.1002/mus.24527.
50. Exercise and physical therapy for SMA. URL: https://smanewstoday.com/sma-and-exercise/ (дата обращения 14.05.2024).
51. Mehta M., Bechard L.J., Dolan M., et al. Energy imbalance and the risk of overfeeding in critically ill children. Pediatr Crit Care Med. 2011; 12 (4): 398–405. https://doi.org/10.1097/PCC.0b013e3181fe279c.
52. Cutillo L., Pizziconi C., Tozzi A.E., et al. Predicted and measured resting energy expenditure in children with spinal muscular atrophy 2. J Pediatr. 2014; 164: 1228–30. https://doi.org/10.1016/j.jpeds.2013.12.006.
53. Davis R.H., Godshall B.J., Seffrood E., et al. Nutritional practices at a glance: spinal muscular atrophy type I nutrition survey findings. J Child Neurol. 2014; 29 (11): 1467–72. https://doi.org/10.1177/0883073813503988.
54. Hammer A., Nilsagard Y., Forsberg A., et al. Evaluation of therapeutic riding (Sweden) / hippotherapy (United States). A single-subject experimental design study replicated in eleven patients with multiple sclerosis. Physiother Theory Pract. 2005; 21 (1): 51–77. https://doi.org/10.1080/09593980590911525.
55. Chung B., Wong V., Ip P. Spinal muscular atrophy: survival pattern and functional status. Pediatrics. 2004; 114 (5): e548–53. https://doi.org/10.1542/peds.2004-0668.
56. Mazzone E., Bianco F., Martinelli D., et al. Assessing upper limb function in nonambulant SMA patients: development of a new module. Neuromuscul Disord. 2011; 21 (6): 406–12. https://doi.org/10.1016/j.nmd.2011.02.014.
57. Pera M.C., Coratti G., Forcina N., et al. Content validity and clinical meaningfulness of the HFMSE in spinal muscular atrophy. BMC Neurol. 2017; 17 (1): 39. https://doi.org/10.1186/s12883-017-0790-9.
58. Mazzone E.S., Mayhew A., Montes J., et al. Revised upper limb module for spinal muscular atrophy: development of a new module. Muscle NERVE. 2017; 55 (6): 869–74. https://doi.org/10.1002/mus.25430.
59. Bérard C., Payan C., Hodgkinson I., Fermanian J. A motor function measure for neuromuscular diseases. Construction and validation study. Neuromuscul Disord. 2005; 15 (7): 463–70. https://doi.org/10.1016/j.nmd.2005.03.004.
60. Trundell D., Le Scouiller S., Le Goff L., et al. Assessment of the validity and reliability of the 32-item Motor Function Measure in individuals with type 2 or non-ambulant type 3 spinal muscular atrophy. PLoS One. 2020; 15 (9): e0238786. https://doi.org/10.1371/journal.pone.0238786.
61. Kārkliņa B., Daly D.J., Declerck M. Quantification of aquatic interventions in children with disabilities: a systematic literature review. Int J Aquat Res Educ. 2013; 7 (4): 7. https://doi.org/10.25035/ijare.07.04.07.
62. Cunha M.C., Oliveira A.S., Labronici R.H., Gabbai A.A. Spinal muscular atrophy type II (intermediary) and III (Kugelberg– Welander). Evolution of 50 patients with physiotherapy and hydrotherapy in a swimming pool. Arq Neuropsiquiatr. 1996; 54 (3): 402–6. https://doi.org/10.1590/s0004-282x1996000300007.
63. Salem Y., Gropack S.J. Aquatic therapy for a child with type III spinal muscular atrophy: a case report. Phys Occup Ther Pediatr. 2010; 30 (4): 313–24. https://doi.org/10.3109/01942638.2010.493097.
64. Moore G.E., Lindenmayer A.W., McConchie G.A., et al. Describing nutrition in spinal muscular atrophy: a systematic review. Neuromuscul Disord. 2016; 26 (7): 395–404. https://doi.org/10.1016/j.nmd.2016.05.005.
65. Wadman R.I., De Amicis R., Brusa C., et al. Feeding difficulties in children and adolescents with spinal muscular atrophy type 2. Neuromuscul Disord. 2021; 31 (2): 101–12. https://doi.org/10.1016/j.nmd.2020.12.007.
66. Zhou Y., Chen J., Gong X., et al. Nutrition status survey of type 2 and 3 spinal muscular atrophy in Chinese population. Nutr Neurosci. 2022; 25 (7): 1488–94. https://doi.org/10.1080/1028415X.2020.1871212.
67. Choi Y.A., Suh D.I., Chae J.H., Shin H.I. Trajectory of change in the swallowing status in spinal muscular atrophy type I. Int J Pediatr Otorhinolaryngol. 2020; 130: 109818. https://doi.org/10.1016/j.ijporl.2019.109818.
68. Van der Heul A.M.B., Cuppen I., Wadman R.I., et al. Feeding and swallowing problems in infants with spinal muscular atrophy type 1: an observational study. J Neuromuscul Dis. 2020; 7 (3): 323–30. https://doi.org/10.3233/JND-190465.
69. Ripolone M., Ronchi D., Violano R., et al. Impaired muscle mitochondrial biogenesis and myogenesis in spinal muscular atrophy. JAMA Neurology. 2015; 72 (6): 666–75. https://doi.org/10.1001/jamaneurol.2015.0178.
70. Mesfin A., Sponseller P.D., Leet A.I. Spinal muscular atrophy: manifestations and management. J Am Acad Orthop Surg. 2012; 20 (6): 393–401. https://doi.org/10.5435/JAAOS-20-06-393.
71. Durkin E.T., Schroth M.K., Helin M., Shaaban A.F. Early laparoscopic fundoplication and gastrostomy in infants with spinal muscular atrophy type I. J Pediatr Surg. 2008; 43 (11): 2031–7. https://doi.org/10.1016/j.jpedsurg.2008.05.035.
72. Yerushalmy-Feler A., Levy D., Sagi L., et al. Nutritional therapy in children with spinal muscular atrophy in the era of nusinersen. J Pediatr Gastroenterol Nutr. 2021; 72 (6): e154–e160. https://doi.org/10.1097/MPG.0000000000003055.
73. Chandran S., McCarthy J., Noonan K., et al. Early treatment of scoliosis with growing rods in children with severe spinal muscular atrophy: a preliminary report. J Pediatr Orthop. 2011; 31 (4): 450–4. https://doi.org/10.1097/BPO.0b013e31821722b1.
74. Livingston K., Zurakowski D., Snyder B. Parasol rib deformity in hypotonic neuromuscular scoliosis: a new radiographical definition and a comparison of short-term treatment outcomes with VEPTR and growing rods. Spine. 2015; 40 (13): E780–6. https://doi.org/10.1097/BRS.0000000000000911.
75. Haaker G., Fujak A. Proximal spinal muscular atrophy: current orthopedic perspective. Appl Clin Genet. 2013; 6 (11): 113–20. https://doi.org/10.2147/tacg.S53615.
76. Catteruccia M., Vuillerot C., Vaugier I., et al. Orthopedic management of scoliosis by Garches brace and spinal fusion in SMA type 2 children. J Neuromuscul Dis. 2015; 2 (4): 453–62. https://doi.org/10.3233/JND-150084.
77. Garg S. Management of scoliosis in patients with Duchenne muscular dystrophy and spinal muscular atrophy: a literature review. J Pediatr Rehabil Med. 2016; 9 (1): 23–9. https://doi.org/10.3233/PRM-160358.
78. Проксимальная спинальная мышечная атрофия 5q. Клинические рекомендации. 2023. URL: https://cr.minzdrav.gov.ru/schema/593_3 (дата обращения 10.05.2024).
79. Aton J., Davis R.H., Jordan K.C., et al. Vitamin D intake is inadequate in spinal muscular atrophy type I cohort: correlations with bone health. J Child Neurol. 2014; 29 (3): 374–80. https://doi.org/10.1177/0883073812471857.
80. Shoval H.A., Antelis E., Hillman A., et al. Onabotulinum toxin a injections into the salivary glands for spinal muscle atrophy type I: a prospective case series of 4 patients. Am J Phys Med Rehabil. 2018; 97 (12): 873–8. https://doi.org/10.1097/PHM.0000000000000989.
81. Sankai Y., Suzuki K., Hasegawa Y. (Eds.) Cybernics: fusion of human, machine and information systems. Tokyo: Springer Japan; 2014: 339 pp.
82. Nakajima T., Sankai Y., Takata S., et al. Cybernic treatment with wearable Cyborg Hybrid Assistive Limb (HAL) improves ambulatory function in patients with slowly progressive rare neuromuscular diseases: a multicentre, randomised, controlled crossover trial for efficacy and safety (NCY-3001). Orphanet J Rare Dis. 2021; 16 (1): 304. https://doi.org/10.1186/s13023-021-01928-9.
83. Montes J., Zanotto D., Young S.D., et al. Gait assessment with solesound instrumented footwear in spinal muscul aratrophy. Muscle NERVE. 2017; 56 (2): 230–6. https://doi.org/10.1002/mus.25484.
84. Butchbach M.E.R. Copy number variations in the survival motor neuron genes: implications for spinal muscular atrophy and other neurodegenerative diseases. Front Mol Biosci. 2016; 3: 7. https://doi.org/10.3389/fmolb.2016.00007.
85. Essers J., Murgia A., Peters A., Meijer K. Daily life benefits and usage characteristics of dynamic arm supports in subjects with neuromuscular disorders. Sensors. 2020; 20 (17): 4864. https://doi.org/10.3390/s20174864.
86. Chen X., Wolf D., Siebourg-Polster J., et al. An objective and childfriendly assessment of arm function by using a 3-D sensor. J Vis Exp. 2018; 132: 57014. https://doi.org/10.3791/57014.
87. Давыдова А.М. Зоотерапия как метод коррекционной работы с детьми с ограниченными возможностями здоровья, посещающими Лекотеку. В кн.: Психология: традиции и инновации. Материалы III Международной научной конференции. Самара: Молодой ученый; 2018: 20–2.
88. American Hippotherapy Association. URL: http://www. americanhippotherapyassociation.org (дата обращения 10.05.2024).
89. Lemke D., Rothwell E., Newcomb T.M., Swoboda K.J. Perceptions of equine-assisted activities and therapies by parents and children with spinal muscular atrophy. Pediatr Phys Ther. 2014; 26 (2): 237–44. https://doi.org/10.1097/PEP.0000000000000027.
90. Wang G., Ma R., Wada K., et al. The effect of riding as an alternative treatment for children with cerebral palsy: a systematic review and meta-analysis. Integr Med Int. 2015; 1 (4): 211–22. https://doi.org/10.1159/000368408.
91. Onsager S. Experiences with a service dog of an adolescent with spinal muscular atrophy. 2011. URL: https://soundideas.pugetsound.edu/ms_occ_therapy/24/ (дата обращения 10.05.2024).
92. Service dogs for people with spinal muscular atrophy (SMA). URL: https://assets.roche.com/f/173850/x/4180e8a786/sma_roche_service_dog_guide.pdf (дата обращения 10.05.2024).
93. Rodriguez K.E., Bibbo J., Verdon S., O'Haire M.E. Mobility and medical service dogs: a qualitative analysis of expectations and experiences. Disabil Rehabil Assist Technol. 2020; 15 (5): 499–509. https://doi.org/10.1080/17483107.2019.1587015.
94. Allen K., Blascovich J. The value of service dogs for people with severe ambulatory disabilities. A randomized controlled trial. JAMA. 1996; 275 (13): 1001–6. https://doi.org/10.1001/jama.1996.03530370039028.
95. Fairman S.K., Huebner R.A. Service dogs: a compensatory resource to improve function. Occup Ther Health Care. 2001; 13 (2): 41–52. https://doi.org/10.1080/J003v13n02_03.
96. Abreu N.J., Waldrop M.A. Overview of gene therapy in spinal muscular atrophy and Duchenne muscular dystrophy. Pediatr Pulmonol. 2021; 56 (4): 710–20. https://doi.org/10.1002/ppul.25055.
97. Vitale M., Roye B., Bloom Z., et al. Best practices for the orthopaedic care of children with spinal muscular atrophy: a Consensus Statement from the European Neuromuscular Centre Standard of Care Orthopaedic Working Group. JPOSNA. 2022; 4 (1): 1–16. https://doi.org/10.55275/JPOSNA-2022-0006.
98. Смирнова Н.С., Романовская О.Н., Германенко О.Ю. Практический справочник пациента по правовым основам оказания медицинской помощи и лекарственного обеспечения больных спинальной мышечной атрофией. М.: Проспект; 2020: 168 с.
99. Prior T.W. Carrier screening for spinal muscular atrophy. Genet Med. 2008; 10 (11): 840–2. https://doi.org/10.1097/ GIM.0b013e318188d069.
100. Committee Opinion No. 691: Carrier screening for genetic conditions. Obstet Gynecol. 2017; 129 (3): e41–55. https://doi.org/0.1097/AOG.0000000000001952.
Об авторе
О. Ю. КатиковаРоссия
Катикова Ольга Юрьевна - к.м.н.
Ул. Ярцевская, д. 19а, Москва 121552
Рецензия
Для цитирования:
Катикова О.Ю. Место реабилитации в ведении детей со спинальной мышечной атрофией. Реабилитология. 2024;2(2):227-246. https://doi.org/10.17749/2949-5873/rehabil.2024.18
For citation:
Katikova O.Yu. Rehabilitation in children with spinal muscular atrophy. Journal of Medical Rehabilitation. 2024;2(2):227-246. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.18





