Перейти к:
Важность контроля неврологических проявлений в реабилитации после радикальной гистерэктомии
https://doi.org/10.17749/2949-5873/rehabil.2024.20
Аннотация
Актуальность. Гистерэктомия в настоящее время является одной из наиболее часто выполняемых хирургических операций в акушерстве и гинекологии, уступая только кесареву сечению. Однако такое вмешательство нередко связано с риском возникновения осложнений, в т.ч. неврологической природы. Неврологические последствия ввиду своих особенностей выходят за рамки физических проявлений и оказывают психоэмоциональное давление на пациенток.
Цель: определить необходимость мониторинга неврологических проявлений у женщин, проходящих реабилитацию после перенесенной гистерэктомии.
Материал и методы. Поиск и отбор исследований на русском и английском языках проведен с учетом рекомендаций PRISMA в научных базах и электронных библиотеках PubMed/MEDLINE, ScienceDirect, Google Scholar, Microsoft Academic, DOAJ, eLibrary, КиберЛенинка. Выявлено 2569 публикаций, в результате скрининга отобрано 57 статей, посвященных изучению неврологических нежелательных последствий проведения гистерэктомии и соответствующих всем критериям отбора.
Результаты. Среди упоминаемых неврологических осложнений наиболее распространенным является хроническая послеоперационная боль, которую выявляют в 30% случаев. При этом у подавляющего большинства пациенток такие боли проявляются редко и переносятся как легкий дискомфорт. Однако однозначного понимания природы данного осложнения нет. Имеется теория о существенной роли отношения продукции эстрогенов и вещества Р в болевых проявлениях. Так, сокращение продукции эстрогенов при неизменном синтезе вещества Р в организме значительно снижают болевой порог у пациенток, что и является причиной наблюдаемой хронической боли. Определенный вклад в формирование данного неврологического осложнения вносит резидуальной синдром яичников, который связан с неполным удалением яичников при овариоэктомии, травматической невромы и мононевропатии. Повреждения нервов или их сплетений в области малого таза могут стать причиной кишечных и мочевых расстройств, приводяших к снижению качества жизни пациенток. Чрезмерная тревога и депрессия являются дополнительными факторами риска возникновения хронических болей после проведения гистерэктомии, а сопутствующие послеоперационные изменения нередко имеют физическое проявление, например в виде бессонницы, синдрома беспокойных ног и сексуальной дисфункции.
Заключение. Гистерэктомия безусловно является эффективным способом лечения ряда гинекологических заболеваний, однако нередко становится причиной осложнений, требующих коррекции реабилитационной программы. Неврологические негативные проявления требуют особого мониторинга, т.к. на фоне депрессивного состояния пациенток происходит хронизация патологических процессов.
Ключевые слова
Для цитирования:
Бегович Ё., Демьянов С.В., Демьянов Г.В. Важность контроля неврологических проявлений в реабилитации после радикальной гистерэктомии. Реабилитология. 2024;2(1):122-132. https://doi.org/10.17749/2949-5873/rehabil.2024.20
For citation:
Begovich E., Demyanov S.V., Demyanov G.V. The importance of monitoring neurological manifestations in rehabilitation after radical hysterectomy. Journal of Medical Rehabilitation. 2024;2(1):122-132. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.20
ВВЕДЕНИЕ / INTRODUCTION
Гистерэктомия в настоящее время является одной из наиболее часто выполняемых хирургических операций в акушерстве и гинекологии, уступая только кесареву сечению. По данным Всемирной организации здравоохранения, примерно каждая пятая женщина подвергается такой операции [1]. Высокая частота проведения гистерэктомии связана с высокой распространенностью различных гинекологических заболеваний, нередко требующих именно такого вида лечения: злокачественные опухоли матки и шейки матки, обильные маточные кровотечения, выпадение матки, наружный генитальный эндометриоз и тяжелые случаи внутреннего эндометриоза [2].
Для выполнения гистерэктомии врачи могут использовать различные хирургические подходы: абдоминальный, вагинальный или лапароскопический. Процедура может включать удаление всей матки (тотальная гистерэктомия), удаление дна и тела матки с сохранением шейки матки (субтотальная гистерэктомия) или удаление матки вместе с фаллопиевыми трубами и яичниками (радикальная гистерэктомия). Радикальное хирургическое лечение обычно выбирается для предотвращения дальнейших осложнений, обусловленных течением болезни, однако нежелательные последствия проведения гистерэктомии нередко являются поводом для коррекции реабилитационных программ. Среди таких расстройств выделяют неврологические осложнения.
Растет объем научной литературы, рассматривающей хроническую боль при различных заболеваниях как разновидность неврологической патологии. Хроническая боль − распространенное состояние, которое оказывает негативное влияние на различные аспекты здоровья пациента, включая сон, когнитивные функции, настроение, психическое благополучие, сердечно-сосудистую систему и сексуальную функцию, тем самым снижая качество жизни больных [3–5]. Отсутствие адекватной реабилитационной помощи может являться причиной того, что патофизиологические механизмы, лежащие в основе хронической боли, со временем становятся все более сложными, охватывая как функциональные, так и структурные изменения в нервной системе. Как следствие, ощущение боли переходит от простого симптома к отдельному и автономному патологическому состоянию [6][7].
Последствия хронической боли выходят за рамки ее физических проявлений и могут оказывать пагубное психоэмоциональное воздействие на пациентов, приводить к потере трудоспособности, а также иметь негативный экономический эффект из-за увеличения расходов, связанных с медицинской помощью [4][5][8][9]. Следует отметить, что при оценке долгосрочного воздействия на самочувствие пациента интенсивность и тяжесть хронической боли могут иметь большее значение, чем основное заболевание [6][7].
Цель – определить необходимость мониторинга неврологических проявлений у женщин, проходящих реабилитацию после перенесенной гистерэктомии.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
Поиск англоязычных исследований, посвященных изучению неврологических последствий проведения гистерэктомии, проведен в международных научных базах данных PubMed/MEDLINE, ScienceDirect, Google Scholar, Microsoft Academic, DOAJ. Поиск русскоязычных публикаций осуществлен в научных электронных библиотеках eLibrary и КиберЛенинка. Глубина поиска составила 20 лет. Также учтены результаты запросов в поисковых системах Яндекс и Google. Использованы следующие ключевые слова и словосочетания: «гистерэктомия», «неврологические осложнения», «овариоэктомия», «хроническая боль», «качество жизни», “hysterectomy”, “neurological complications”, “ovariectomy”, “chronic pain”, “quality of life”.
Отбор исследований / Selection of publications
Отбор исследований проведен с учетом рекомендаций PRISMA (рис. 1). Критерием отбора была релевантность теме обзора. Результаты поиска во всех источниках суммировали и проводили отсев дублирующих исследований, публикаций с отсутствием доступа к полному тексту, нерелевантных работ и исследований, полученных из сомнительных источников.
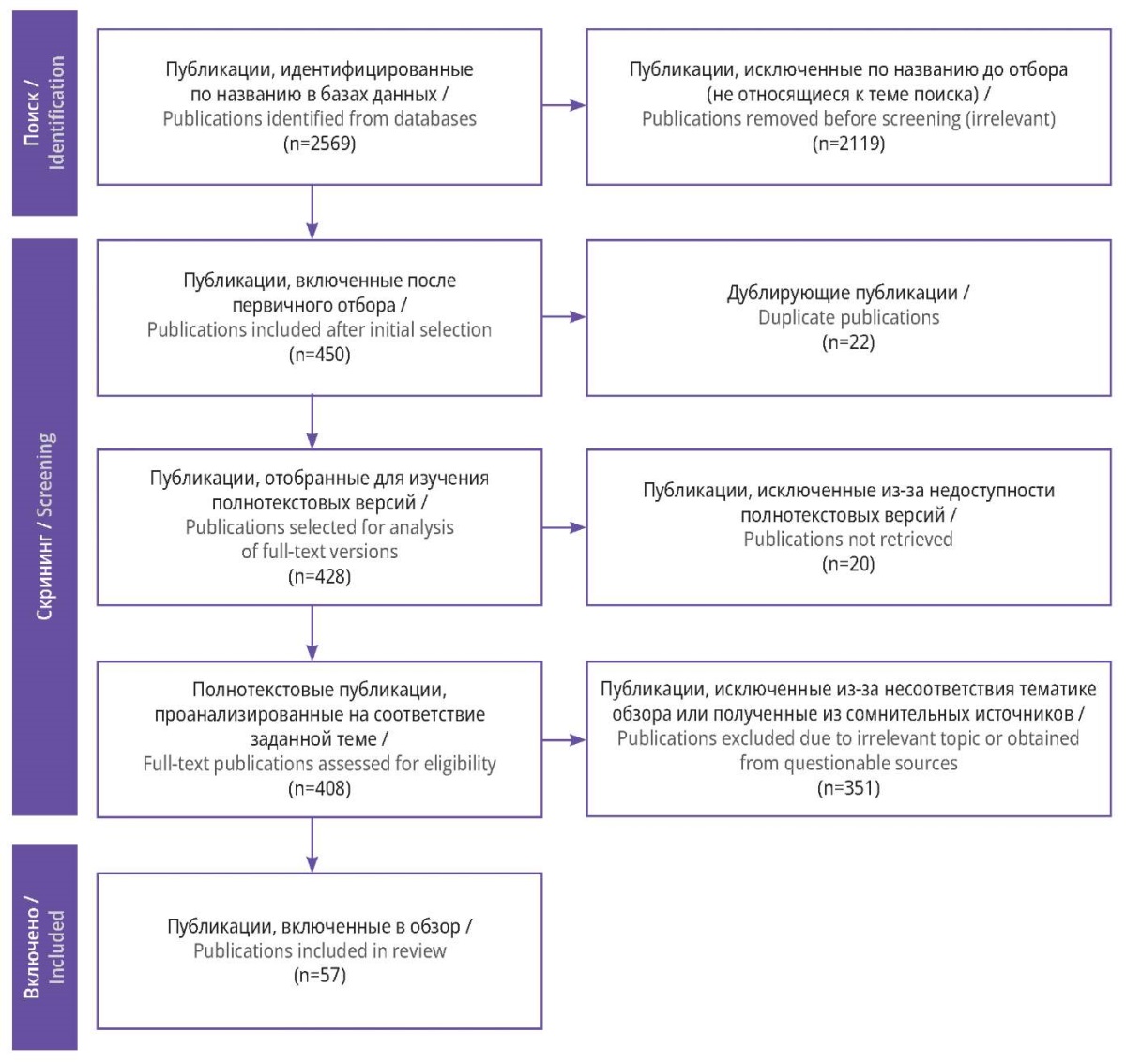
Рисунок 1. Блок-схема отбора публикаций с учетом рекомендаций PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews
and Meta-Analyses) workflow for selection of publications
Всего выявлено 2569 публикаций, из которых 450 были посвящены изучению неврологических осложнений после проведения гистерэктомии. После процедуры скрининга из анализа исключены 22 статьи, которые целиком дублировали другие исследования, что объясняется некоторым перекликанием результатов поиска в разных базах данных. Таким образом, для дальнейшего ознакомления с полным текстом было отобрано 428 работ. Полный доступ был получен только к 408 статьям. По результатам подробной оценки текстов 57 работ являлись релевантными, полученными из рецензируемых журналов или иных авторитетных источников, и представленные авторами выводы были безусловно уникальными. Данные публикации были проанализированы в рамках обзора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Хроническая боль после гистерэктомии / Chronic pain after hysterectomy
В настоящее время распространенным неврологическим осложнением после процедуры гистерэктомии является хроническая послеоперационная боль, относящаяся к состоянию значительной степени тяжести. Это расстройство определяют по следующим критериям: появление или усиление боли после хирургического вмешательства, продолжительность не менее 3 мес, локализация в области разреза или области таза, а также исключение других потенциальных источников боли [7].
Хроническая боль отмечается у 30% женщин, перенесших гистерэктомию, преимущественно в области таза или в месте разреза, реже во влагалище или пояснице. Обнадеживает тот факт, что в 85% случаев данные боли проявляются редко, при этом 92% женщин сообщают о проявлении боли как о легком дискомфорте. Следовательно, у подавляющего большинства пациенток нет необходимости использовать обезболивающие препараты, такие как парацетамол или нестероидные противовоспалительные средства [10].
Тем не менее в случаях повышенной тяжести проявления боли происходит существенное изменение образа жизни пациентки. Отмечено значительное влияние данного состояния на способность передвигаться, работать, отдыхать и получать удовольствие от жизни в целом, что приводит к заметному снижению общего качества жизни [7][10].
Есть несколько факторов, которые могут увеличить вероятность возникновения хронической боли после гистерэктомии. К ним относятся боли в области таза, выявленные до операции, сильная боль в ближайшем послеоперационном периоде, абдоминальная гистерэктомия, молодой возраст и наличие определенной генетической предрасположенности [11][12].
Первичной детерминантой, которая обусловливает высокий риск возникновения хронических болей, является измененное эмоциональное состояние, включающее предоперационную тревогу и депрессию, а также послеоперационные опасения, связанные с ожиданием пациенткой потенциальных устойчивых проблем после удаления матки. К таким опасениям относят существенное ухудшение здоровья, а также период длительного восстановления. При изучении причин хронической боли после гистерэктомии крайне важно определить предрасположенность пациентки к возникновению этого осложнения, что позволит своевременно применить альтернативные терапевтические подходы [3][13].
В настоящее время понимание механизмов развития хронической боли после гистерэктомии и овариоэктомии ограничено. Преобладает теория, в которой ключевая роль уделена центральной сенсибилизации. Исследования показали, что эстрогены оказывают значительный обезболивающий эффект путем взаимодействий рецепторов эстрогена, обнаруженных в чувствительных нейронах, расположенных в спинномозговых ганглиях. Указанные взаимодействия приводят к сокращению выработки вещества Р – важнейшего нейромедиатора, вызывающего боль. Следовательно, высвобождение вещества Р аксонами этих чувствительных нейронов задних рогов спинного мозга снижается, что вызывает уменьшение передачи возбуждения от них к структурам головного мозга через восходящие афферентные пути. Высвобождение вещества Р в ответ на болевые стимулы не всегда достигает достаточно высокого уровня, чтобы вызвать осознание боли, что приводит к повышению порога болевой чувствительности. Это явление, известное как эстрогеновая модуляция болевой чувствительности, особенно проявляется во время беременности [14].
В случаях, когда проводится двусторонняя овариоэктомия, обезболивающего действия эстрогенов уже не наблюдается. При избыточной выработке вещества Р некоторые отделы центральной нервной системы, в т.ч. спинной мозг, ретикулярная формация, таламус, гипоталамус, лимбическая система, базальные ганглии и кора головного мозга, испытывают повышенную возбудимость. Такое постоянное состояние возбудимости приводит к упомянутой ранее центральной сенсибилизации, что снижает порог болевой чувствительности и устраняет необходимость в стимуляции болевых рецепторов. Подсчитано, что примерно 50% случаев хронической послеоперационной боли после двусторонней овариоэктомии имеют невропатическое происхождение [15].
Тем не менее овариоэктомия не всегда совпадает с проведением гистерэктомии, и женщины продолжают страдать от стойких послеоперационных болей даже при нормальном уровне эстрогена. В таких случаях предоперационная тревога потенциально может способствовать развитию осложнений [16]. Нарушенный эмоциональный фон (депрессия и тревога) уже давно признан значимым фактором риска хронической боли. Исследования показали, что у человека в состоянии тревоги наблюдаются высокие уровни кортикотропина, норадреналина и различных цитокинов, включая интерлейкин (ИЛ) 1, ИЛ-6, ИЛ-10 и фактор некроза опухоли альфа. Эти вещества играют роль в активации глиальных клеток, особенно астроцитов, которых много в поясной извилине – области, участвующей в регуляции боли и эмоций. Наличие глиального фибриллярного кислого белка (англ. glial fibrillary acidic protein, GFAP), продуцируемого астроцитами, изменяет функционирование поясной коры, постепенно приводя к развитию послеоперационной нейропатической боли [16][17]. В этом конкретном сценарии мы можем еще раз обнаружить возникновение центральной сенсибилизации.
В некоторых случаях этиология хронической боли после гистерэктомии не связана с центральной сенсибилизацией. Например, развитие послеоперационных спаек может приводить к их растяжению при смещении органов малого таза, тем самым стимулируя болевые рецепторы, сдавливая кровеносные сосуды и вызывая ишемию тканей. Проявлению хронической тазовой боли могут способствовать рецидивы гинекологического рака, проведение лучевой и химиотерапии после удаления матки по поводу злокачественных новообразований, резидуального синдрома яичников, травматических невром, активирующих разнообразные болевые механизмы [11][18]. В свою очередь, резидуальный синдром яичников и травматические невромы в рамках изучения хронической боли представляют наибольший интерес, поскольку в научной литературе их часто упускают из виду как потенциальные факторы, приводящие к возникновению неврологических осложнений после гистерэктомии.
Овариореминантный синдром / Ovarian remnant syndrome
Овариореминантный синдром, также известный как резидуальный синдром яичников, впервые был описан в 1970 г. и относится к непреднамеренному неполному удалению ткани яичника во время проведения овариоэктомии. Развитию этого синдрома способствуют несколько факторов риска, включая эндометриоз, воспалительные заболевания органов малого таза и кишечника, а также множественные операции на органах брюшной полости и таза. Такие обстоятельства приводят к образованию плотных спаек между яичником и прилегающими тканями, например брюшиной. Во время проведения овариоэктомии, которая часто совпадает с гистерэктомией, хирург может случайно отсоединить часть яичника, плотно связанную с этими спайками, оставив ее на окружающих тканях [19].
Таким образом, использование тупого разделения ранее существовавших спаек во время проведения овариоэктомии крайне неблагоприятно. Кроме того, значимые факторы риска, способствующие возникновению овариореминантного синдрома, включают интраоперационное кровотечение и структурные или позиционные аномалии яичников. Также существует вероятность эктопической имплантации ткани яичника, например в брюшную стенку, при проведении лапароскопической гистерэктомии и овариоэктомии. Эта органная масса будет сохраняться в прилегающих тканях.
Несмотря на кажущееся прекращение притока крови к оставшейся ткани яичника, она остается функциональной. Исследования, проведенные на животных моделях, показали, что примерно 75% остаточной ткани подвергается реваскуляризации, в результате чего возобновляются выработка эстрогена и созревание фолликулов [19][20]. Общие симптомы этого синдрома включают постоянную или повторяющуюся боль в области таза, характеризующуюся тупыми или иногда острыми ощущениями, а также дисфункцию мочевыводящих путей и кишечника, болезненные ощущения при половом акте, вагинальное кровотечение [19, 21]. Нечасто остаточная ткань яичника может вызывать как злокачественные, так и доброкачественные новообразования, такие как аденокарцинома, цистаденома и цистаденофиброма. Когда молодая женщина, перенесшая овариоэктомию, не испытывает ожидаемых симптомов менопаузы, связанных со значительным снижением уровня эстрогена (вазомоторные симптомы, изменения настроения и сухость влагалища), несмотря на то что она не получает заместительной гормональной терапии, можно заподозрить остаточный синдром яичников. Кроме того, у таких пациенток часто наблюдаются нормальные уровни эстрадиола и фолликулостимулирующего гормона в крови [19][22].
Сознательное решение сохранить яичники в организме женщины после гистерэктомии следует дифференцировать от овариореминантного синдрома. Данное состояние влечет за собой различные изменения в яичниках, такие как развитие кист, очагов эндометриоза, а также доброкачественных и злокачественных опухолей. Эти изменения вызывают постоянные боли в области таза и диспареунию, что приводит к необходимости удаления яичников примерно через 5 лет после гистерэктомии. Следует отметить, что это обстоятельство встречается нечасто, затрагивая лишь 2% пациенток, у которых яичники сохранились после гистерэктомии [20][23].
Травматическая неврома как осложнение хирургического вмешательства / Traumatic neuroma as a complication of surgical intervention
Травматическая неврома возникает в результате повреждения нерва, вызванного травмой или хирургическими процедурами. В таких случаях оторванные аксоны восстанавливаются беспорядочно, что приводит к образованию сложной сети нервных окончаний, простирающихся в различных направлениях. Иногда они могут даже устанавливать синаптические связи друг с другом. Обычно этот сложный клубок окружен фибробластами, которые участвуют в развитии рубца, состоящего из соединительной ткани, эффективно инкапсулируя неправильно регенерированный нерв [24][25].
Неврома – это образование, характеризующееся наличием узелков, размер которых может достигать нескольких сантиметров. Она состоит из аксонов, шванновских клеток и коллагеновых волокон, разбросанных в случайном порядке. Первоначальное повреждение нерва вместе с давлением, оказываемым невромой, приводит к изменению функциональности ионных каналов на мембране аксона. В результате появляется спонтанная боль в районе невромы, известная как невропатическая боль, а также локализованно снижается порог болевой чувствительности. При сниженном болевом пороге даже небольшое давление на новообразованный нарост вызывает ощущение жгучей боли [26].
Невромы могут развиваться в течение 1–12 мес после повреждения как соматических, так и вегетативных нервов. Они чаще всего наблюдаются после операций на голове, шее и груди и могут даже регрессировать естественным путем, если имеют небольшой размер. В гинекологической практике значение имеют также травматические невромы, особенно после гистерэктомии, где их можно выявить. В этом случае невромы формируются на поврежденных вегетативных нервах яичников, матки и влагалища, что приводит к различным жалобам у пациенток. Ярким симптомом травматических невром является хроническая боль в области таза, которая может как сохраняться постоянно, так и иметь периодический характер, описываемый как ощущение жжения. Проявление хронической боли усиливается при таких действиях пациентки, как поднятие тяжестей и поддержание вертикального положения, которые оказывают повышенное давление на неврому. Больные зачастую оценивают боль на 8 баллов из 10 по визуальной аналоговой шкале и сообщают о значительных ограничениях в своей повседневной деятельности [27].
Степень влияния травматической невромы на развитие хронической боли в области таза после гистерэктомии в настоящее время недооценена. Например, такую боль часто связывают со спайками в области таза, возникшими в результате удаления матки. Тем не менее, если боль сохраняется даже после удаления спаек, возникает необходимость учитывать возможность травматической невромы. Дополнительными признаками, указывающими на образование невромы, могут быть выявление диспареунии и дискомфорта во время дефекации [24].
Коррекцию данного осложнения обычно проводят путем консервативного лечения: назначения опиоидных препаратов и антидепрессантов (которые считаются наиболее эффективными препаратами при нейропатической боли), физиотерапии и блокады местными анестетиками. К сожалению, эти методы приносят лишь временное облегчение, поэтому наиболее эффективным лечением является хирургическое удаление пораженных невром. В последнее время изучается эффективность применения радиочастотной денервации как альтернативы текущим методам терапии, поскольку она вызывает некроз определенных нервов, тем самым существенно снижая вероятность возникновения травматической невромы [28].
Мононевропатии при гинекологических операциях / Mononeuropathies in gynecological operations
Нейропатии после хирургического лечения гинекологических заболеваний встречаются нечасто, примерно у 2% пациенток. К первичным нервам, поражаемым во время хирургического вмешательства, относятся бедренный, общий малоберцовый, бедренно-половой нервы и латеральный кожный нерв бедра [29].
Выделяют по меньшей мере две основные причины возникновения нейропатии после операции. Первая причина связана с чрезмерным давлением, оказываемым ретрактором на большую поясничную мышцу при проведении гистерэктомии. В результате такого давления может произойти повреждение бедренного нерва, проходящего под этой мышцей, а также бедренно-полового нерва, проникающего в ее толщу. Вторая причина связана с неправильным положением пациентки во время хирургической процедуры: чрезмерное сгибание, отведение и наружная ротация бедра в положении Тренделенбурга, что приводит к сдавлению бедренного нерва и латерального кожного нерва бедра, которые оба проходят под паховой связкой. Кроме того, общий малоберцовый нерв, огибающий головку малоберцовой кости, подвержен повреждению, если при проведении гистерэктомии на ступни и ноги пациентки оказывается чрезмерное давление со стороны опор для ног [29][30].
К первичным клиническим симптомам нейропатии бедренного нерва относятся нарушения сгибания бедра и разгибания ноги в коленном суставе, обусловленные снижением иннервации большой поясничной мышцы и четырехглавой мышцы бедра. Это состояние не мешает пациентке ходить по ровным поверхностям, однако создает серьезные трудности при подъеме по лестнице. И наоборот, невропатия общего малоберцового нерва характеризуется слабостью мышц – разгибателей стопы и пальцев, что приводит к развитию состояния, известного как опущение стопы. В результате у пациентки меняется походка: она поднимает ногу выше, чтобы избежать контакта пальца ноги с землей. Как и при невропатии бедренного нерва, типичны сенсорные нарушения в определенных областях нижних конечностей. В случае нейропатии латерального кожного нерва боль и необычные ощущения возникают вдоль передней наружной поверхности бедра, особенно усиливаясь при разгибании тазобедренного сустава. Повреждение бедренно-полового нерва вызывает изменение чувствительности в передней части бедра и может также проявляться болью в паху [30].
Вышеупомянутые воздействия приводят к незначительному повреждению самого нерва, затрагивая двигательные волокна нервного пучка [29][31]. Вследствие сжатия нерва кратковременно прерывается передача импульса, а более интенсивное сжатие или растяжение вызывает разрыв аксонов. Однако шванновские клетки остаются интактными и впоследствии полностью устраняют повреждение [29][32]. Поэтому послеоперационная невропатия обычно проходит в течение нескольких недель или месяцев, хотя бывают случаи, когда она сохраняется более года. Факторы, предрасполагающие к неблагоприятным послеоперационным исходам, включают низкий индекс массы тела (ниже 20 кг/м²) и наличие анемии в анамнезе.
Расстройства сексуальной̆ функции после гистерэктомии / Sexual dysfunction after hysterectomy
К осложнениям проведенной гистерэктомии относят также сексуальную дисфункцию, которая проявляется снижением либидо, уменьшением сексуального возбуждения, неудовлетворенностью оргазмом и возникновением диспареунии [33].
Снижение либидо объясняется отсутствием в организме пациентки гормонов, продуцируемых яичниками, поскольку примерно половина гистерэктомий проводится с двусторонней овариоэктомией, что усугубляет развитие депрессии и изменение самовосприятия после операции. Удаление матки приводит к нарушению процессов сексуального возбуждения и соответствующих физиологических реакций половых органов, таких как отек стенок влагалища и вагинальные выделения. Данные нарушения соотносятся с изменением диаметра сосудов таза и нарушением кровообращения [27]. Кроме того, при одновременной овариоэктомии наблюдается снижение уровня циркулирующих эстрогенов и андрогенов. В результате ухудшается состояние ткани стенки влагалища и недостаточно вырабатывается вагинальный секрет. Неудовлетворенности оргазмом в основном подвержены женщины, которые в значительной степени полагаются на стимуляцию шейки матки для его достижения. Следует отметить, что оргазм сопровождается скоординированными сокращениями миометрия, что, вероятно, влияет на интенсивность удовольствия. Наконец, диспареуния может возникнуть из-за развития влагалищных рубцов, сужения, уменьшения длины и сухости слизистой оболочки [34][35].
В современной научной литературе, касающейся сексуальных расстройств после гистерэктомии, встречаются противоречивые данные [36–39]. Некоторые исследователи утверждают, что сексуальная дисфункция является неизбежным последствием удаления матки, тогда как другие указывают на отсутствие изменений или даже на улучшение сексуальной функции женщин. Наблюдаемое разногласие можно связать со следующими четырьмя факторами.
Во-первых, гистерэктомия, проводимая при «доброкачественных» заболеваниях матки, в частности при лейомиоме и выпадении матки, хронических тазовых болях и маточных кровотечениях, не оказывает существенного эффекта на половую функцию, поскольку все вышеперечисленные заболевания обязательно изначально вносят сексуальные нарушения в жизнь пациенток [40]. Только 10–20% женщин этой категории продолжают испытывать сексуальные проблемы после гистерэктомии. Важно отметить, что гистерэктомия, выполняемая по поводу злокачественных новообразований, у большинства пациенток вызывает сексуальную дисфункцию (чаще всего снижение полового возбуждения). Это можно объяснить тем, что при злокачественных новообразованиях удаляют не только матку, но и околоматочную клетчатку, параметральную ткань, важные части связок таза, вегетативные нервы, что значительно повышает риск развития сексуальных расстройств [33].
Во-вторых, проводимую совместно с гистерэктомией овариоэктомию обычно обозначают как основной предиктор сексуальной дисфункции, поскольку одновременное удаление яичников всегда вызывает подобные нарушения. В то же время применение заместительной гормональной терапии зачастую является недостаточным для восстановления сексуальной функции [34].
В-третьих, операционное вмешательство может затрагивать места сексуальной стимуляции, приводящей к оргазму. Так, у 60% женщин оргазм связан со стимуляцией клитора, у 25% − влагалища, у 15% − шейки матки. Это означает, что у женщин, у которых оргазм возникает преимущественно в шейке матки, сексуальная дисфункция после гистерэктомии выражена значительно сильнее, чем у других [35].
Наконец, выделяют совокупность предоперационных факторов, оказывающих негативное влияние на сексуальную функцию. Нередко причиной снижения сексуальной активности являлись и заболевания, для лечения которых приходилось проводить гистерэктомию, и психологические расстройства, в частности депрессия [40].
Нарушения активности центральной нервной системы и связанные с ними двигательные изменения / Disorders of central nervous system activity and related motor changes
Связь двусторонней овариоэктомии с последующими изменениями гормонального фона, эмоциональными расстройствами, нарушением когнитивных и двигательных функций, снижением качества сна представляет собой важный вопрос, заслуживающий отдельного рассмотрения. Исследования показали, что предоперационная тревога играет значительную роль в возникновении послеоперационной хронической боли [16]. Тем не менее наличие у пациентки тревожно-депрессивных расстройств, особенно в период от диагностики злокачественного новообразования до хирургического удаления опухоли, в настоящее время зачастую соотносится с нарушением сна [41].
У значительной части женщин, перенесших радикальное хирургическое лечение онкогинекологических заболеваний, отмечается ухудшение качества сна, при этом до 78% сообщают о различных нарушениях: бессонница (а именно трудности с засыпанием), частые пробуждения ночью или ранним утром, гиперсомния (в частности чрезмерная дневная сонливость), нарушение дневного функционирования, парасомния (например, ночные кошмары), нарушения дыхания во сне, кашель, громкий храп, ощущение жара или холода, а также боли в области таза и ног. У таких пациенток часто наблюдается сокращение продолжительности ночного сна, и многие прибегают к использованию снотворных [41][42]. Кроме того, нарушение сна еще больше усугубляет тревожно-депрессивные расстройства, приводя к заметному снижению качества жизни больных.
Следует признать, что снижение уровня эстрогенов у женщин, подвергшихся двусторонней овариоэктомии, является независимым фактором риска возникновения депрессивноподобных аффективных расстройств. Например, показано, что пациентки, получающие послеоперационную заместительную терапию эстрогенами, имеют значительно меньшую вероятность развития депрессии. Кроме того, распространенность депрессии среди женщин, перенесших как гистерэктомию, так и овариоэктомию, относительно высока и составляет примерно 10% [43].
Помимо эмоциональных расстройств нарушение сна может быть связано с психологическими факторами, такими как неудовлетворенность женщин своим телом, особенно в отношении шрамов, оставшихся после абдоминальной гистерэктомии, которые часто воспринимаются как уродство. Эта сопровождается снижением самооценки, поскольку больные воспринимают себя непривлекательными и лишенными женственности, испытывают дистресс из-за утраты репродуктивных возможностей [44][45]. Психологические факторы, несомненно, оказывают существенное влияние на развитие тревожно-депрессивного синдрома. Рассматривая причины нарушений сна, можно выделить определенные социально-демографические факторы: молодость женщины, низкий социально-экономический статус, отсутствие семейного положения и детей. Данные факторы оказывают влияние на самооценку человека при рассмотрении себя как части общества и признания со стороны социального окружения [46].
Примерно 11% женщин, перенесших гистерэктомию с последующей двусторонней овариоэктомией, испытывают двигательные нарушения, связанные со сном. Синдром беспокойных ног является наиболее распространенным заболеванием и характеризуется неприятными ощущениями в ногах в состоянии покоя. Перед сном эти ощущения усиливаются и являются причиной непреодолимого желания шевелить ногами, что препятствует засыпанию [47]. Текущие знания указывают на существенную роль эстрогенов в выработке дофамина в черной субстанции мозга и регулировании функционирования нигростриатных нейронов. Снижение уровня эстрогена после овариоэктомии нарушает нормальную деятельность базальных ганглиев, что приводит к развитию различных двигательных нарушений, в т.ч. паркинсонизму или синдрому беспокойных ног. Первичное лечение этих синдромов включает дофаминергические препараты, такие как агонисты дофаминовых рецепторов и леводопа [48].
На сегодняшний день существует сравнительно мало публикаций, посвященных изучению взаимосвязи между уровнями эстрогена в кровотоке и синтезом дофамина, а также влияния двусторонней овариоэктомии на когнитивные функции женщин. Недавние исследования показали, что эстрогены способствуют развитию новых синапсов в гиппокампе и поясной извилине. Соответственно, у женщин, перенесших овариоэктомию, процессы нейропластичности ослабляются, что приводит к постепенному снижению когнитивных способностей. В первую очередь страдает память, поскольку гиппокамп и поясная извилина отвечают за консолидацию следов памяти и облегчение перехода от кратковременной памяти к долговременной [49].
Дисфункция нижних мочевыводящих путей и кишечника после гистерэктомии / Dysfunction of the lower urinary tract and intestines after hysterectomy
После проведенной гистерэктомии нередко отмечают изменения в работе нижних мочевыводящих путей, в т.ч. затруднения и дискомфорт во время мочеиспускания, спорадический поток мочи, недержание мочи, недостаточное опорожнение мочевого пузыря, частое и ночное мочеиспускание [35]. Эти расстройства проявляются примерно у четверти женщин, перенесших гистерэктомию. Они сохраняются на протяжении всей оставшейся жизни и потенциально могут привести к серьезным осложнениям, проявляющимся камнями в моче, инфекцией почек, аномальным отеком почек и даже разрывом мочевого пузыря, что впоследствии может вызвать перитонит [35][50].
Фактором риска появления дисфункции нижних мочевыводящих путей после хирургического вмешательства является возраст, поскольку существует прямая корреляция между увеличением возраста и риском неблагоприятного исхода после процедуры. Дизурические расстройства связывают с ослаблением мышц тазового дна и детрузора мочевого пузыря, происходящим из-за дегенерации гладкомышечных волокон вследствие старения организма, а также со снижением уровня кальция в кровотоке у пожилых людей [51–53].
Частота выявления нарушений функции кишечника сравнительно ниже. К ним относят боль в животе, диарею, ощущение неполного стула. Наиболее часто отмечают запор, возникающий у каждой десятой женщины после проведения гистерэктомии. Эти симптомы обычно связаны с синдромом раздраженного кишечника [54][55].
Считается, что основной причиной кишечных и мочевых расстройств после гистерэктомии является повреждение нижнего подчревного (тазового) сплетения, которое состоит из парасимпатических и симпатических нервов, иннервирующих прямую кишку, мочевой пузырь, матку, влагалище и другие органы [56]. Следует отметить, что это сплетение расположено рядом с влагалищем, что приводит к более частому возникновению проблем с мочеиспусканием и дефекацией при вагинальной гистерэктомии по сравнению с абдоминальной гистерэктомией [57]. Другим потенциальным фактором риска возникновения кишечной дисфункции после гистерэктомии является снижение концентрации простагландинов, особенно простагландинов Е2, которые необходимы для нормальной моторики желудочно-кишечного тракта. Отсутствие этих веществ связано с тем, что удаленная матка является важнейшим производителем простагландинов в женском организме.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Сравнение гистерэктомии с другими операциями по удалению органов с точки зрения влияния на жизнь пациентки представляет собой сложную задачу. Эта процедура безусловно является эффективным способом лечения заболевания, однако нередко приводит к целому ряду осложнений. Совокупность таких нежелательных последствий не только создает медицинские проблемы для пациенток и медицинского персонала, участвующего в реабилитации, но и создает биологические, социальные и психологические проблемы для женщин после оказания медицинской поддержки.
У значительного числа пациенток, перенесших гистерэктомию, в жизни происходят существенные негативные изменения, часто вызывающие развитие тяжелой депрессии. Депрессивное состояние затрудняет восстановление организма после операции и способствует возникновению и хронизации неврологических нарушений. После гистерэктомии женщины могут испытывать хроническую послеоперационную боль и/или хроническую боль в результате остаточного синдрома яичников, травматической невромы, а также мононевропатии, сексуальные расстройства и нарушения сна, снижение когнитивных и двигательных функций, дисфункцию нижних мочевых путей и кишечника. Эти состояния приводят к значительному снижению качества жизни пациенток и требуют проведения своевременной коррекции реабилитационных программ.
Список литературы
1. Pinto P.R., McIntyre T., Araújo-Soares V., et al. Psychological factors predict an unfavorable pain trajectory after hysterectomy: a prospective cohort study on chronic postsurgical pain. Pain. 2018; 159 (5): 956–67. https://doi.org/10.1097/j.pain.0000000000001170.
2. Nikolajsen L. Perioperative interventions for the reduction of chronic postsurgical pain. Pain. 2017; 158 (5): 769–70. https://doi.org/10.1097/j.pain.0000000000000852.
3. Fine P.G. Long-term consequences of chronic pain: mounting evidence for pain as a neurological disease and parallels with other chronic disease states. Pain Med. 2011; 12 (7): 996–1004. https://doi.org/10.1111/j.1526-4637.2011.01187.x.
4. Янушевич О.О., Рабинович С.А. Неврология лица: пароксизмальные невралгии (вклад профессора В.А. Карлова). Эпилепсия и пароксизмальные состояния. 2021; 13 (1S): 17–20. https://doi.org/10.17749/2077-8333/epi.par.con.2021.073.
5. Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин: руководство для врачей. 2-е изд. М.: БИНОМ; 2019: 896 с.
6. McCarberg B.H., Nicholson B.D., Todd K.H., et al. The impact of pain on quality of life and the unmet needs of pain management: results from pain sufferers and physicians participating in an Internet survey. Am J Ther. 2008; 15 (4): 312–20. https://doi.org/10.1097/MJT.0b013e31818164f2.
7. Brandsborg B., Nikolajsen L. Chronic pain after hysterectomy. Curr Opin Anaesthesiol. 2018; 31 (3): 268–73. https://doi.org/10.1097/ACO.0000000000000586.
8. Путилина М.В., Теплова Н.В., Герасимова О.С. Концепция синдромальных диагнозов остеоартрита и боль в спине как причина неэффективности медикаментозной терапии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (3): 407–14. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.104.
9. Боброва О.П., Зырянов С.К., Шнайдер Н.А., Петрова М.М. Фармакоэкономический анализ применения сильных опиоидов для лечения хронического болевого синдрома у пациентов с раком поджелудочной железы. ФАРМАКОЭКОНОМИКА Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (3): 281–90. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.080.
10. Han C., Ge Z., Jiang W., et al. Incidence and risk factors of chronic pain following hysterectomy among Southern Jiangsu Chinese women. BMC Anesthesiol. 2017; 17 (1): 103. https://doi.org/10.1186/s12871-017-0394-3.
11. Richards L., Healey M., Cheng C., Dior U. Laparoscopic oophorectomy to treat pelvic pain followingovary-sparing hysterectomy: factors associated with surgical complications and pain persistence. J Minim Invasive Gynecol. 2019; 26 (6): 1044–9. https://doi.org/10.1016/j.jmig.2018.10.005.
12. James S.K. Chronic postsurgical pain: is there a possible genetic link? Br J Pain. 2017; 11 (4): 178–85. https://doi.org/10.1177/2049463717723222.
13. Weinrib A.Z., Azam M.A., Birnie K.A., et al. The psychology of chronic post-surgical pain: new frontiers in risk factor identification, prevention and management. Br J Pain. 2017; 11 (4): 169–77. https://doi.org/10.1177/2049463717720636.
14. Sarajari S., Oblinger M.M. Estrogen effects on pain sensitivity and neuropeptide expression in rat sensory neurons. Exp Neurol. 2010; 224 (1): 163–9. https://doi.org/10.1016/j.expneurol.2010.03.006.
15. Podlasz P., Wasowicz K. Effect of partial hysterectomy on the neurons of the paracervical ganglion (PCG) of the pig. PLoS One. 2021; 16 (1): e0245974. https://doi.org/10.1371/journal.pone.0245974.
16. Gu D., Zhou M., Han C., et al. Preoperative anxiety induces chronic postoperative pain by activating astrocytes in the anterior cingulate cortex region. Rev Assoc Med Bras (1992). 2019; 65 (9): 1174–80. https://doi.org/10.1590/1806-9282.65.9.1174.
17. Li L.H., Wang Z.C., Yu J., Zhang Y.Q. Ovariectomy results in variable changes in nociception, mood and depression in adult female rats. PLoS One. 2014; 9 (4): e94312. https://doi.org/10.1371/journal.pone.0094312.
18. Chapman C.R., Vierck C.J. The transition of acute postoperative pain to chronic pain: an integrative overview of research on mechanisms. J Pain. 2017; 18 (4): 359.e1–38. https://doi.org/10.1016/j.jpain.2016.11.004.
19. Magtibay P.M., Magrina J.F. Ovarian remnant syndrome. Clin Obstet Gynecol. 2006; 49 (3): 526–34. https://doi.org/10.1097/00003081-200609000-00012.
20. Fu S.C., Su H.Y. Residual ovarian syndrome: a case report with classic symptoms, imaging and pathology findings, and treatment. Taiwan J Obstet Gynecol. 2018; 57 (5): 753–4. https://doi.org/10.1016/j.tjog.2018.08.027.
21. Nahar K., Amatullah M., Khatun K., et al. Clinico-pathological evaluation of residual ovary syndrome: a cross sectional study. Mymensingh Med J. 2021; 30 (4): 997–1002.
22. Magtibay P.M., Nyholm J.L., Hernandez J.L., Podratz K.C. Ovarian remnant syndrome. Am J Obstet Gynecol. 2005; 193 (6): 2062–6. https://doi.org/10.1016/j.ajog.2005.07.067.
23. Asgari Z., Tehranian A., Rouholamin S., et al. Comparing surgical outcome and ovarian reserve after laparoscopic hysterectomy between two methods of with and without prophylactic bilateral salpingectomy: a randomized controlled trial. J Cancer Res Ther. 2018; 14 (3): 543–8. https://doi.org/10.4103/0973-1482.193114.
24. Sunderji Z., Buitenhuis D., Lee G., et al. Vaginal vault traumatic neuromas. J Minim Invasive Gynecol. 2019; 26 (7): 1219–20. https://doi.org/10.1016/j.jmig.2019.04.012.
25. Cramer S.F., Heller D.S. Postablation neuroma of the myometrium – а report of 5 cases. Hum Pathol. 2017; 67: 211–6. https://doi.org/10.1016/j.humpath.2017.08.013.
26. Abdulcadir J., Tille J.C., Petignat P. Management of painful clitoral neuroma after female genital mutilation/cutting. Reprod Health. 2017; 14 (1): 22. https://doi.org/10.1186/s12978-017-0288-3.
27. Nama V., Patel A., Pawade J., Murdoch J. Traumatic neuroma after hysterectomy and bilateral salpingo-oophorectomy: a rare cause of post hysterectomy pelvic pain. J Minim Invasive Gynecol. 2016; 23 (7): 1189–90. https://doi.org/10.1016/j.jmig.2016.07.006.
28. Taheri A., Lajevardi M., Firouzian A., et al. Regarding: traumatic neuroma after hysterectomy. a rare cause of posthysterectomy pelvic pain. J Minim Invasive Gynecol. 2017; 24 (1): 177–8. https://doi.org/10.1016/j.jmig.2016.10.014.
29. Bradshaw A.D., Advincula A.P. Postoperative neuropathy in gynecologic surgery. Obstet Gynecol Clin North Am. 2010; 37 (3): 451–9. https://doi.org/10.1016/j.ogc.2010.05.008.
30. Sze E.H.M. An alternate approach to using candy cane stirrups in vaginal surgery. Obstet Gynecol. 2019; 133 (4): 666–8. https://doi.org/10.1097/AOG.0000000000003184.
31. Abdalmageed O.S., Bedaiwy M.A., Falcone T. Nerve injuries in gynecologic laparoscopy. J Minim Invasive Gynecol. 2017; 24 (1): 16–27. https://doi.org/10.1016/j.jmig.2016.09.004.
32. Addley S., McMullan J.C., Scott S., Soleymani Majd H. “Well-leg” compartment syndrome associated with gynaecological surgery: a perioperative risk-reduction protocol and checklist. BJOG. 2021; 128 (9): 1517–25. https://doi.org/10.1111/1471-0528.16749.
33. Beyan E., İnan A.H., Emirdar V., et al. Comparison of the effects of total laparoscopic hysterectomy and total abdominal hysterectomy on sexual function and quality of life. Biomed Res Int. 2020; 2020: 8247207. https://doi.org/10.1155/2020/8247207.
34. Danesh M., Hamzehgardeshi Z., Moosazadeh M., Shabani-Asrami F. The effect of hysterectomy on women’s sexual function: a narrative review. Med Arch. 2015; 69 (6): 387–92. https://doi.org/10.5455/medarh.2015.69.387-392.
35. Ekanayake C., Pathmeswaran A., Herath R., Wijesinghe P. Vaginal, sexual and urinary symptoms following hysterectomy: a multi-centre randomized controlled trial. Womens Midlife Health. 2020; 6: 1. https://doi.org/10.1186/s40695-020-0049-2.
36. Bayram G.O., Şahin N.H. Hysterectomy’s psychosexual effects in Turkish women. Sex Disabil. 2008; 26 (3): 149–58. https://doi.org/10.1007/s11195-008-9085-9.
37. Lonnée-Hoffmann R., Pinas I. Effects of hysterectomy on sexual function. Curr Sex Health Rep. 2014; 6 (4): 244–51. https://doi.org/10.1007/s11930-014-0029-3.
38. Fram K.M., Saleh S.S., Sumrein I.A. Sexuality after hysterectomy at University of Jordan Hospital: a teaching hospital experience. Arch Gynecol Obstet. 2013; 287 (4): 703–8. https://doi.org/10.1007/s00404-012-2601-2.
39. Rhodes J.C., Kjerulff K.H., Langenberg P.W., Guzinski G.M. Hysterectomy and sexual functioning. JAMA. 1999; 282 (20): 1934–41. https://doi.org/10.1001/jama.282.20.1934.
40. Wang Y., Ying X. Sexual function after total laparoscopic hysterectomy or transabdominal hysterectomy for benign uterine disorders: a retrospective cohort. Braz J Med Biol Res. 2020; 53 (3): e9058. https://doi.org/10.1590/1414-431X20199058.
41. Aquil A., El Kherchi O., El Azmaoui N., et al. Body image dissatisfaction and lower self-esteem as major predictors of poor sleep quality in gynecological cancer patients after surgery: cross-sectional study. BMC Womens Health. 2021; 21 (1): 229. https://doi.org/10.1186/s12905-021-01375-5.
42. Strollo S.E., Fallon E.A., Gapstur S.M., Smith T.G. Cancer-related problems, sleep quality, and sleep disturbance among long-term cancer survivors at 9-years post diagnosis. Sleep Med. 2020; 65: 177–85. https://doi.org/10.1016/j.sleep.2019.10.008.
43. Azizi Kutenaee M., Amirjani S., Asemi Z., et al. The impact of depression, self-esteem, and body image on sleep quality in patients with PCOS: a cross-sectional study. Sleep Breath. 2020; 24 (3): 1027–34. https://doi.org/10.1007/s11325-019-01946-9.
44. Ates O., Soylu C., Babacan T., et al. Assessment of psychosocial factors and distress in women having adjuvant endocrine therapy for breast cancer: the relationship among emotional distress and patient and treatment-related factors. Springerplus. 2016; 5: 486. https://doi.org/10.1186/s40064-016-2136-2.
45. Teo I., Cheung Y.B., Lim T.Y.K., et al. The relationship between symptom prevalence, body image, and quality of life in Asian gynecologic cancer patients. Psychooncology. 2018; 27 (1): 69–74. https://doi.org/10.1002/pon.4457.
46. Wu I.H.C., Tsai W., McNeill L.H., Lu Q. The associations of self-stigma, social constraints, and sleep among Chinese American breast cancer survivors. Support Care Cancer. 2020; 28 (8): 3935–44. https://doi.org/10.1007/s00520-019-05233-x.
47. Huo N., Smith C.Y., Gazzuola Rocca L., et al. Association of premenopausal bilateral oophorectomy with restless legs syndrome. JAMA Netw Open. 2021; 4 (2): e2036058. https://doi.org/10.1001/jamanetworkopen.2020.36058.
48. Muth C.C. Restless legs syndrome. JAMA. 2017; 317 (7): 780. https://doi.org/10.1001/jama.2016.21375.
49. Zeydan B., Tosakulwong N., Schwarz C.G., et al. Association of bilateral salpingo-oophorectomy before menopause onset with medial temporal lobe neurodegeneration. JAMA Neurol. 2019; 76 (1): 95–100. https://doi.org/10.1001/jamaneurol.2018.3057.
50. Koroglu N., Aslan Cetin B., Akca A., et al. A comparison of pelvic organ prolapse and sexual function after abdominal and laparoscopic hysterectomy. Ginekol Pol. 2018; 89 (10): 553–7. https://doi.org/10.5603/GP.a2018.0094.
51. Hardy C.C. The aged lower urinary tract: deficits in neural control mechanisms. Front Aging. 2021; 2: 791833. https://doi.org/10.3389/fragi.2021.791833.
52. Katz M., Silverstein N., Coll P., et al. Surgical care of the geriatric patient. Curr Probl Surg. 2019; 56 (7): 260–329. https://doi.org/10.1067/j.cpsurg.2019.03.003.
53. Nishii H. A review of aging and the lower urinary tract: the future of urology. Int Neurourol J. 2021; 25 (4): 273–84. https://doi.org/10.5213/inj.2142042.021.
54. Khoshbaten M., Melli M.S., Fattahi M.J., et al. Irritable bowel syndrome in women undergoing hysterectomy and tubular ligation. Gastroenterol Hepatol Bed Bench. 2011; 4 (3): 138–41.
55. Camilleri M. Irritable bowel syndrome: straightening the road from the Rome criteria. Neurogastroenterol Motil. 2020; 32 (11): e13957. https://doi.org/10.1111/nmo.13957.
56. Sun X.L., Wang H.B., Wang Z.Q., et al. Effect of transcutaneous electrical stimulation treatment on lower urinary tract symptoms after class III radical hysterectomy in cervical cancer patients: study protocol for a multicentre, randomized controlled trial. BMC Cancer. 2017; 17: 416. https://doi.org/10.1186/s12885-017-3387-1.
57. Bergman I., Söderberg M.W., Kjaeldgaard A., Ek M. Cervical amputation versus vaginal hysterectomy: a population-based register study. Int Urogynecol J. 2017; 28 (2): 257–66. https://doi.org/10.1007/s00192-016-3119-0.
Об авторах
Ё. БеговичРоссия
Бегович Ёвана
ул. Трубецкая, д. 8/2, Москва 119048
С. В. Демьянов
Россия
Демьянов Семен Валерьевич
ул. Трубецкая, д. 8/2, Москва 119048
Г. В. Демьянов
Россия
Демьянов Глеб Валерьевич
ул. Трубецкая, д. 8/2, Москва 119048
Рецензия
Для цитирования:
Бегович Ё., Демьянов С.В., Демьянов Г.В. Важность контроля неврологических проявлений в реабилитации после радикальной гистерэктомии. Реабилитология. 2024;2(1):122-132. https://doi.org/10.17749/2949-5873/rehabil.2024.20
For citation:
Begovich E., Demyanov S.V., Demyanov G.V. The importance of monitoring neurological manifestations in rehabilitation after radical hysterectomy. Journal of Medical Rehabilitation. 2024;2(1):122-132. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.20






