Перейти к:
Динамическая оценка содержания маркеров воспаления в крови пациенток в периоде реабилитации после хирургического лечения наружного генитального эндометриоза
https://doi.org/10.17749/2949-5873/rehabil.2024.26
Аннотация
Актуальность. При оказании реабилитационной помощи женщинам с наружным генитальным эндометриозом (НГЭ), перенесшим хирургическое лечение, требуется междисциплинарный подход к подбору стратегии ведения пациенток и средств объективного контроля состояния их здоровья.
Цель: определить целесообразность использования биомаркеров воспаления у женщин, проходящих реабилитацию после хирургического лечения НГЭ, для оценки качества медицинской помощи.
Материал и методы. В исследование были включены 40 пациенток с НГЭ (основная группа), 40 пациенток с другими гинекологическими патологиями (группа сравнения) и 40 почти здоровых женщин (контрольная группа). Все участницы с гинекологическими патологиями проходили хирургическое лечение с последующей реабилитацией. Выраженность воспалительного процесса оценивали по содержанию в сыворотке крови следующих биомаркеров воспаления: интерлейкин-6 (англ. interleukin 6, IL-6), фактор некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-a), цитруллинированный гистон Н3 (англ. citrullinated histone H3, CitH3) и отношение «нейтрофилы/лимфоциты» (англ. neutrophil to lymphocyte ratio, NLR). Динамику изменения уровней данных биомаркеров определяли до хирургического лечения, через 1 нед и через 3 мес после операции.
Результаты. Оценка концентрации биомаркеров воспаления в сыворотке крови указала на наличие воспалительных процессов у больных основной группы и группы сравнения. В то же время уровни IL-6, TNF-a, CitH3 и NLR у пациенток с НГЭ были статистически значимо выше по сравнению с аналогичными показателями у женщин с другими гинекологическими патологиями. Через 1 нед после хирургического вмешательства в основной группе отмечено существенное увеличение концентраций IL-6, CitH3 и NLR и уменьшение уровня TNF-a по отношению к исходным значениям. Через 3 мес после операции в основной группе наблюдалось значительное снижение выраженности воспалительного процесса по сравнению с показателями через 1 нед после лечения. При этом в ряде случаев уровни биомаркеров воспаления было статистически значимо ниже по сравнению с исходными значениями. Примечательно уменьшение сывороточной концентрации CitH3 до показателя у почти здоровых женщин.
Заключение. У пациенток с НГЭ зарегистрировано течение воспалительного процесса, поддающееся коррекции путем хирургического вмешательства. Показана целесообразность использования сывороточной концентрации
CitH3 в качестве маркера контроля качества проведения оперативного лечения НГЭ и ведения пациенток на восстановительном этапе.
Ключевые слова
Для цитирования:
Байгалмаа Б., Бицадзе В.О., Ефанов А.Е., Войновский А.Е. Динамическая оценка содержания маркеров воспаления в крови пациенток в периоде реабилитации после хирургического лечения наружного генитального эндометриоза. Реабилитология. 2024;2(3):286-294. https://doi.org/10.17749/2949-5873/rehabil.2024.26
For citation:
Baigalmaa B., Bitsadze V.O., Efanov A.Е., Voynovskiy A.Е. Dynamic assessment of blood inflammation markers in patients during the rehabilitation period after surgical treatment for external genital endometriosis. Journal of Medical Rehabilitation. 2024;2(3):286-294. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.26
ВВЕДЕНИЕ / INTRODUCTION
Ведение пациенток гинекологического профиля после хирургического лечения на восстановительном этапе требует высококвалифицированного и мультидисциплинарного подхода. Так, наибольшее внимание в оказании реабилитационной помощи следует уделять больным, перенесшим радикальное хирургическое лечение новообразований репродуктивной системы [1][2].
Среди наиболее распространенных заболеваний гинекологического характера, связанных с новообразованиями, выделяют эндометриоз. По самым скромным подсчетам в отдельных эпидемиологических исследованиях, около 1% женщин страдают эндометриозом. Согласно результатам ретроспективного популяционного исследования V.H. Eisenberg et al. (2018 г.), частота выявления эндометриоза у пациенток в Израиле составляет 1,1% [3]. Z. Pugsley et al. (2007 г.) [4] и K.D. Ballard et al. (2008 г.) [5] указали на частоту встречаемости эндометриоза 1,5% среди женщин в Великобритании. В ретроспективном исследовании, посвященном анализу распространенности эндометриоза в Германии, S. Abbas et al. (2012 г.) [6] сообщили о частоте встречаемости заболевания, равной 8,1 случая на 1000 женщин (0,81%), при этом наибольшая частота отмечена среди пациенток в возрасте от 35 до 44 лет – 12,8 случая на 1000 (1,3%). Более пессимистические оценки свидетельствуют о наличии эндометриоза у 10% женщин репродуктивного возраста во всем мире [7][8]. Таким образом, можно сделать заключение о сравнительно высокой распространенности эндометриоза и необходимости решения проблем в данной области.
Для понимания эффективности предпринимаемых реабилитационных мероприятий еще на этапе планирования восстановительного курса появляется потребность отбора биомаркеров объективного контроля состояния пациенток с эндометриозом. Однако в научном сообществе вопрос диагностической значимости ряда биомаркеров при эндометриозе остается предметом дискуссий. Одним из достаточно показательных примеров является неоднозначная позиция по диагностической значимости биомаркеров течения воспалительного процесса при данной нозологии. Так, в исследованиях S. Cho et al. (2008 г.) [9], A. Tokmak et al. (2016 г.) [10], A. Turgut et al. (2019 г.) [11] показано, что у женщин с эндометриозом величина отношения «нейтрофилы/лимфоциты» существенно выше по сравнению пациентками с другими доброкачественными гинекологическими патологиями или здоровыми добровольцами. В то же время в клинических исследованиях B. Seckin et al. (2018 г.) [12], P. Viganò et al. (2018 г.) [13], A. Yavuzcan et al. (2013 г.) [14] не обнаружено схожих изменений или не подтверждена статистическая значимость при проведении подобного сравнения. Таким образом, есть определенная потребность в выяснении природы выявленных разногласий и определении объективных инструментов контроля состояния пациенток гинекологического профиля после хирургического лечения.
Особенно актуальным становится вопрос качества проводимого лечения и реабилитации у пациенток с болевыми формами эндометриоза, в частности при наружном генитальном эндометриозе (НГЭ). При НГЭ отмечается существенное снижение качества жизни, которое проявляется в уменьшении двигательной, социальной активности, развитии тревоги и депрессии. Данные проявления сопровождаются регулярными тазовыми болями, диспареунией и переходят в сексуальную дисфункцию. Отсутствие высококвалифицированной медицинской помощи и персонифицированного подхода к реабилитации пациенток этого профиля может негативно сказаться на их психологическом состоянии, вплоть до возникновения суицидальных наклонностей [15][16]. Таким образом, актуален вопрос поиска оптимальных и объективных инструментов оценки состояния больных после хирургического лечения НГЭ на этапе реабилитации.
Цель – определить целесообразность использования биомаркеров воспаления у женщин, проходящих реабилитацию после хирургического лечения НГЭ, для оценки качества медицинской помощи.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проведено проспективное сравнительное контролируемое интервенционное исследование для определения целесообразности использования биомаркеров воспаления в оценке качества оперативного лечения у женщин с НГЭ.
Критерии включения и исключения / Inclusion and exclusion criteria
При формировании когорты исследования использовали следующие критерии включения:
– женский пол;
– возраст 18–50 лет;
– подтвержденный диагноз НГЭ III–IV степеней (поставленный по пересмотренной классификации Общества врачей по репродуктивной медицине [17]), или подтвержденный диагноз доброкачественных новообразований репродуктивных органов (в т.ч. функциональные кисты яичника, дермоидные кисты яичника, кисты желтого тела), или отсутствие гинекологических заболеваний;
– подписанное информированное добровольное согласие.
Критерии исключения:
– отсутствие возможности верификации диагноза и динамического мониторинга состояния здоровья на всех этапах проведения исследования с учетом конкретной клинической ситуации;
– послеоперационные осложнения;
– отказ от участия в исследовании.
Группы пациенток / Patient groups
Участницы исследования были разделены на три группы:
– основная группа – 40 женщин с НГЭ;
– группа сравнения – 40 пациенток с иными доброкачественными гинекологическими патологиями;
– контрольная группа – 40 почти здоровых женщин.
Хирургическое лечение и восстановительный этап / Surgery and recovery stages
Пациентки из основной группы и группы сравнения проходили хирургическое лечение гинекологических заболеваний путем пангистерэктомии или двусторонней аднексэктомии с удалением очагов патологических тканей.
Стратегия ведения участниц исследования из основной группы и группы сравнения на восстановительном этапе была определена в соответствии с клиническими рекомендациями Министерства здравоохранения Российской Федерации для каждой выявленной нозологии1.
Методы обследования / Examination methods
Эффективность проведенного лечения и ведения на восстановительном этапе пациенток основной группы и группы сравнения была оценена по результатам трех визитов: 1-й визит – до проведения операции, 2-й визит – через 1 нед после хирургического вмешательства, 3-й визит – через 3 мес после него. Участницы контрольной группы проходили обследование в сопоставимое с остальными пациентками время.
У всех участниц на каждом визите проводили сбор анамнеза, клиническую беседу и осуществляли гинекологический осмотр. Выполняли физикальное и инструментальное обследования, а также проверку наличия критериев исключения из исследования. Дополнительно пациентки из основной группы и группы сравнения консультировались терапевтом и реабилитологом.
В качестве биомаркеров воспаления были выбраны сывороточные концентрации интерлейкина-6 (англ. interleukin 6, IL-6), фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α), цитруллинированного гистона Н3 (англ. citrullinated histone H3, CitH3), а также отношение «нейтрофилы/лимфоциты» (англ. neutrophil to lymphocyte ratio, NLR).
Статистический анализ / Statistical аnalysis
Анализ первичных данных, полученных в исследовании, не выявил нормального распределения выборок в тесте Шапиро–Уилка, поэтому дальнейшую обработку данных проводили с использованием непараметрических тестов. Межгрупповое сравнение количественных показателей проводили с помощью теста Краскела–Уоллиса и последующего апостериорного сравнения с использованием теста Данна. Внутригрупповое сравнение количественных показателей выполняли с исходными данными внутри каждой группы с применением теста Вилкоксона. Сравнение качественных показателей между группами осуществляли с помощью критерия χ². Различия считали статистически значимыми при p<0,05. Данные на рисунках представлены в виде медианы и межквартильного размаха. Результаты измерений в тексте приведены в виде медианы, 1-го и 3-го квартилей (Me [Q1; Q3]).
РЕЗУЛЬТАТЫ / RESULTS
Клинико-анамнестические данные / Clinical and anamnestic data
Сравнение частоты встречаемости гинекологических патологий среди участниц исследования не выявило каких-либо характерных особенностей, которые можно было бы соотнести с фактом наличия НГЭ. Отмеченная статистически значимая разница в частоте встречаемости кист яичников была связана с особенностями дизайна исследования, а именно с отбором в группу сравнения пациенток с доброкачественными заболеваниями гинекологической природы, в т.ч. с кистами яичников. Подробные данные представлены в таблице 1.
Таблица 1. Распределение участниц исследования по гинекологическим патологиям, n (%)
Table 1. Distribution of study participants by gynecological pathologies, n (%)
Гинекологическая патология / Gynecological pathology | Контрольная группа / Control group (n=40) | Группа сравнения / Comparison group (n=40) | Основная группа / Main group (n=40) |
Наружный генитальный эндометриоз / External genital endometriosis | |||
I–II стадий / Stages I–II | – | – | – |
III стадии / Stage III | – | – | 25 (62,5) |
IV стадии / Stage IV | – | – | 15 (37,5) |
Миома матки / Uterine fibroids | – | 16 (40) | 23 (57,5) |
Гиперплазия эндометрия / Endometrial hyperplasia | – | 13 (32,5) | 14 (35,0) |
Кисты яичников / Ovarian cysts | – | 40 (100,0) | 11 (27,5)* |
Цервикальная интраэпителиальная неоплазия / Cervical intraepithelial neoplasia | – | 13 (32,5) | 7 (17,0) |
Бесплодие / Infertility | – | 21 (52,5) | 13 (32,5) |
Примечание. * Различия с показателем группы сравнения статистически значимы на уровне p<0,05 (критерий χ²).
Note. Differences with the comparison group values are statistically significant at p<0.05 (χ² criterion).
Динамика уровней биомаркеров воспалительных процессов / Dynamics of inflammatory biomarker levels
Оценка динамики показателей биомаркеров воспаления среди участниц исследования указала на развитие воспаления у женщин, которым было назначено хирургическое лечение выявленного гинекологического заболевания. При этом у пациенток с НГЭ течение воспалительного процесса имело более выраженный характер, на что указывали более высокие уровни биомаркеров. Подробные результаты приведены на рисунках 1–4.
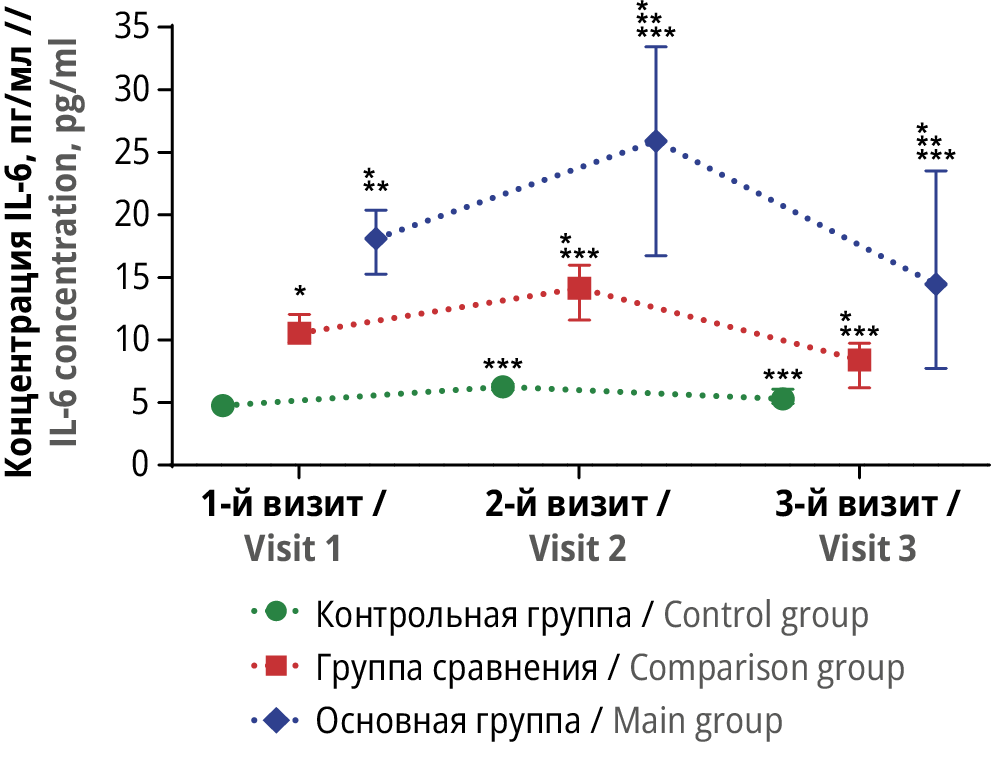
Рисунок 1. Динамика сывороточной концентрации интерлейкина-6 (англ. interleukin 6, IL-6) в трех группах исследования в трех контрольных точках.
* Различия с показателем контрольной группы статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). ** Различия с показателем группы сравнения статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). *** Различия с исходными значениями внутри группы статистически значимы на уровне p<0,05 (критерий Вилкоксона)
Figure 1. Dynamics of serum interleukin-6 (IL-6) in three study groups at three time points.
* Differences with control group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). ** Differences with comparison group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). *** Differences with baseline values within the group are statistically significant at p<0.05 (Wilcoxon test)
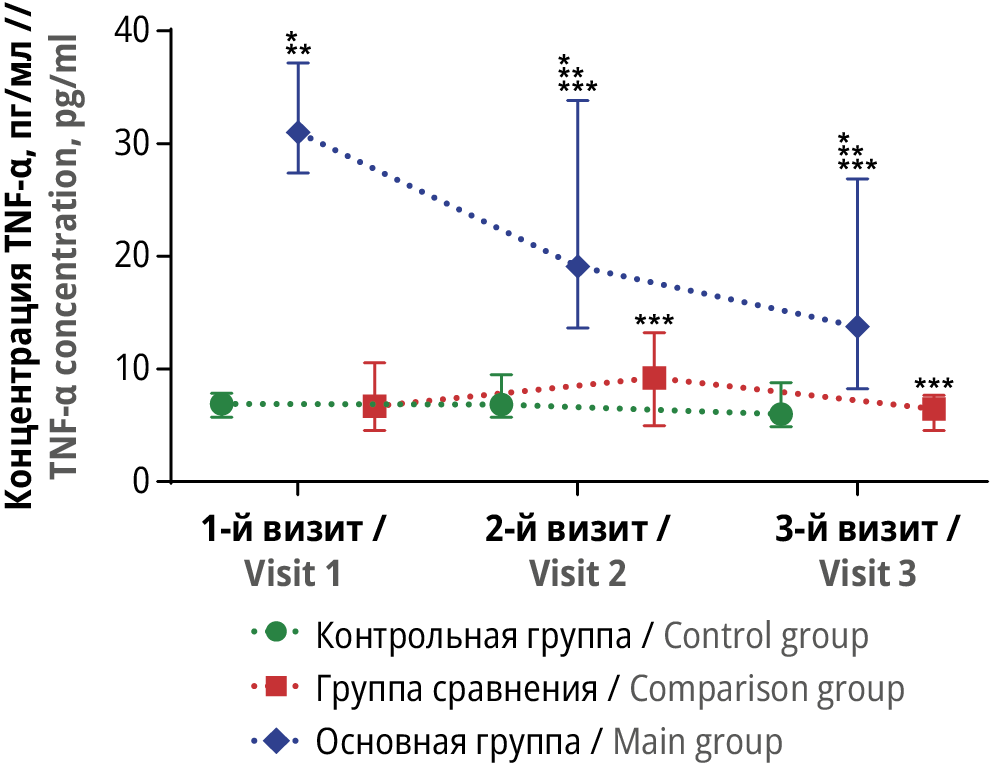
Рисунок 2. Динамика сывороточной концентрации фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) в трех группах исследования в трех контрольных точках.
* Различия с показателем контрольной группы статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). ** Различия с показателем группы сравнения статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). *** Различия с исходными значениями внутри группы статистически значимы на уровне p<0,05 (критерий Вилкоксона)
Figure 2. Dynamics of serum tumor necrosis factor alpha (TNF-α) in three study groups at three time points.
* Differences with control group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests).** Differences with comparison group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). *** Differences with baseline values within the group are statistically significant at p<0.05 (Wilcoxon test)
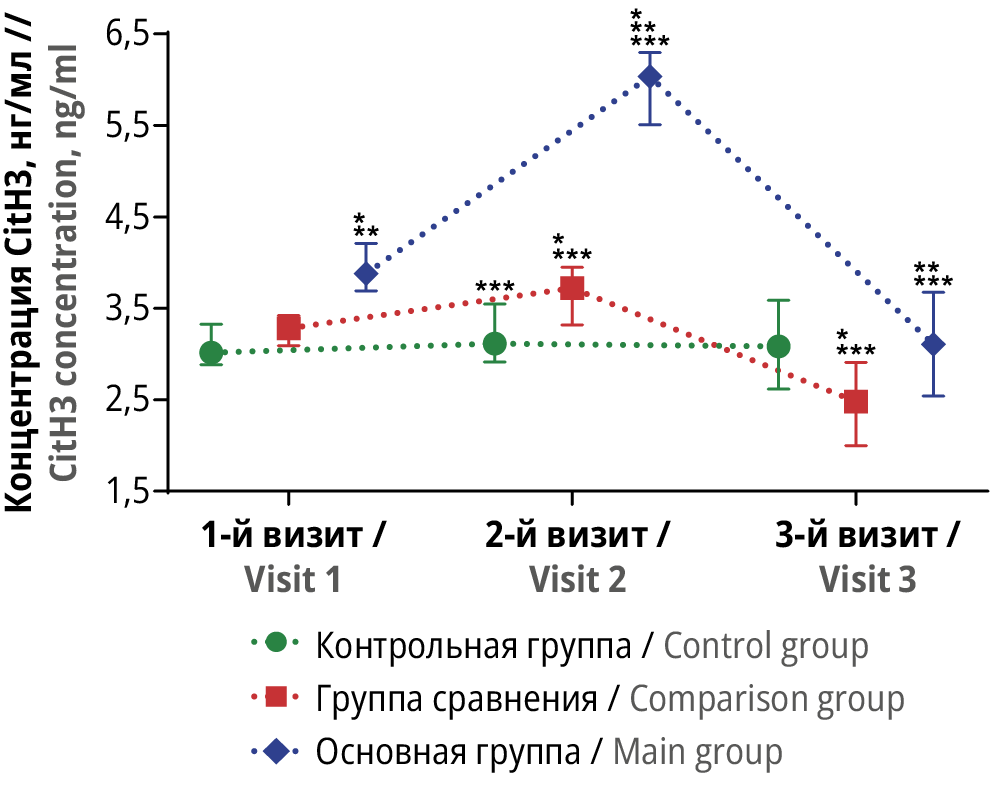
Рисунок 3. Динамика сывороточной концентрации цитруллинированного гистона Н3 (англ. citrullinated histone H3, CitH3) в трех группах исследования в трех контрольных точках.
* Различия с показателем контрольной группы статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). ** Различия с показателем группы сравнения статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). *** Различия с исходными значениями внутри группы статистически значимы на уровне p<0,05 (критерий Вилкоксона)
Figure 3. Dynamics of serum citrullinated histone H3 (CitH3) in three study groups at three time points.
* Differences with control group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). ** Differences with comparison group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). *** Differences with baseline values within the group are statistically significant at p<0.05 (Wilcoxon test)
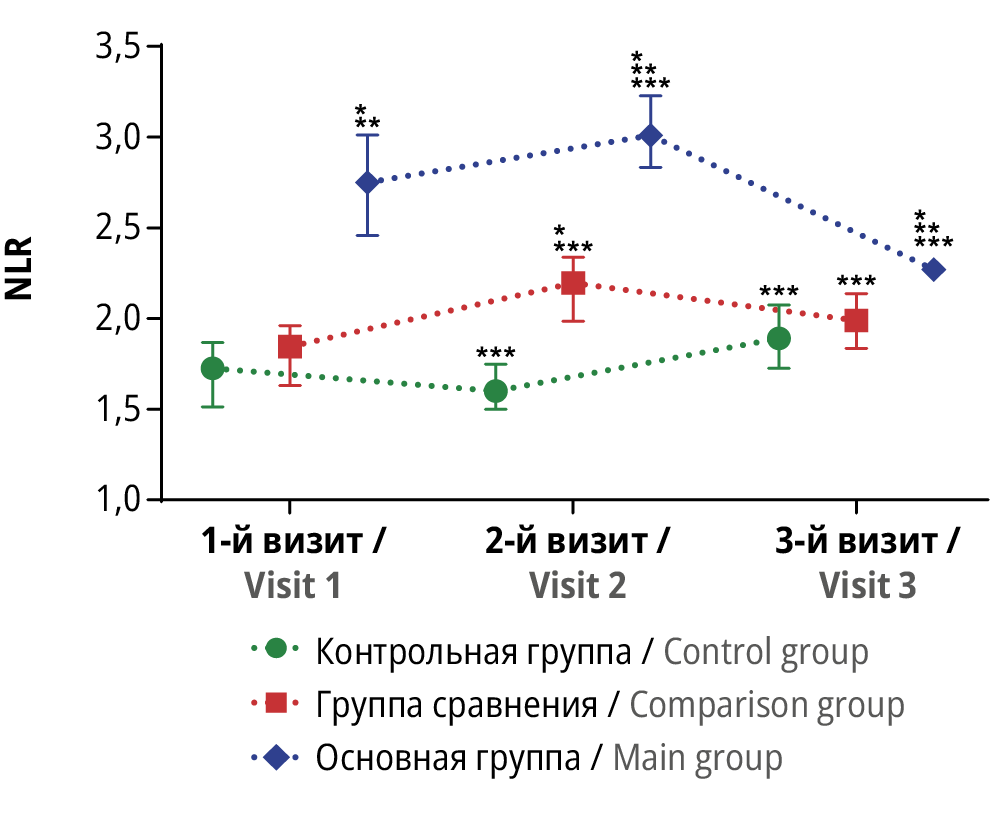
Рисунок 4. Динамика величины отношения «нейтрофилы/лимфоциты» (англ. neutrophil to lymphocyte ratio, NLR) в трех группах исследования в трех контрольных точках.
* Различия с показателем контрольной группы статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). ** Различия с показателем группы сравнения статистически значимы на уровне p<0,05 (тесты Краскела–Уоллиса и Данна). *** Различия с исходными значениями внутри группы статистически значимы на уровне p<0,05 (критерий Вилкоксона)
Figure 4. Dynamics of neutrophil to lymphocyte ratio (NLR) in three study groups at three time points.
* Differences with control group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). ** Differences with comparison group values are statistically significant at p<0.05 (Kruskal–Wallis and Dunn tests). *** Differences with baseline values within the group are statistically significant at p<0.05 (Wilcoxon test)
До операции
На 1-м визите среди пациенток с НГЭ наблюдалось выраженное и статистически значимое увеличение концентрации всех оцененных биомаркеров воспаления: IL-6, TNF-α, CitH3, а также величины NLR по отношению к аналогичным показателям у женщин с другими гинекологическими патологиями или у почти здоровых женщин (p<0,05 для каждого случая).
Через 1 нед после операции
На 2-м визите у пациенток основной группы и группы сравнения отмечено выраженное и статистически значимое увеличение сывороточной концентрации IL-6, CitH3 и величины NLR (p<0,05 для каждого случая). В то же время достаточно необычным оказалось выраженное и статистически значимое снижение концентрации TNF-α у пациенток с НГЭ в данной контрольной точке по сравнению с исходными значениями (19,1 [ 13,75; 32,88] и 31 [ 27,6; 37,13] пг/мл соответственно; p<0,05). При этом у пациенток, прошедших хирургическое лечение других доброкачественных новообразований, отмечали статистически значимое увеличение данного показателя по сравнению с исходными значениями – с 6,7 [ 4,65; 10,45] до 9,2 [ 5,25-12,88] пг/мл (p<0,05).
Через 3 мес после операции
На 3-м визите у пациенток с НГЭ или другими доброкачественными гинекологическими заболеваниями зарегистрировано сокращение выраженности воспалительной реакции по отношению к изменениям, наблюдавшимся через 1 нед после операции. При этом в ряде случаев уровни оцениваемых биомаркеров снижались статистически значимо по отношению к исходным значениям.
В частности, отмечено существенное уменьшение концентрации CitH3 у женщин основной группы спустя 3 мес после хирургического вмешательства по отношению к исходным значениям – 3,11 [ 2,63; 3,59] против 3,88 [ 3,7; 4,21] нг/мл (p<0,05). При этом уровни СitH3 у пациенток с НГЭ и у почти здоровых женщин (3,09 [ 2,63; 3,56] пг/мл) были сопоставимы. Во всех остальных случаях между пациентками основной группы и участницами из группы сравнения или контрольной группы различия в уровнях оцениваемых биомаркеров оставались статистически значимыми.
ОБСУЖДЕНИЕ / DISCUSSION
Природа возникновения и особенности течения воспалительных процессов при различных патологических состояниях до сих пор остаются предметом дискуссий в научном сообществе, которые затрагивают также выявление механизма развития воспалительного процесса при НГЭ. Известно, что снижение его выраженности на этапе восстановления может послужить маркером эффективности проведенного лечения или подтверждением правильного выбора реабилитационной стратегии [18][19]. Исходя из этого, оценка динамики уровней биомаркеров воспаления у женщин с НГЭ позволит частично прояснить природу воспалительного процесса при эндометриозе и оценить качество лечения, а также подход к ведению пациенток на восстановительном этапе.
Проведенный анализ распространенности гинекологических заболеваний и осложнений среди участниц исследования не выявил каких-либо характерных особенностей, которые можно ассоциировать с развитием эндометриоза. Примечательно, что, несмотря на специфическую природу заболевания, связанного с разрастанием эндометриоидной ткани, у женщин с НГЭ также отмечались и другие гинекологические патологии, в т.ч. представленные доброкачественными опухолями. Данное наблюдение позволяет сделать предположение об отсутствии выраженного влияния НГЭ на частоту встречаемости других гинекологических патологий. Однако ввиду малой выборки пациенток в нашей работе данная гипотеза требует подтверждения в более масштабном по количеству участниц исследовании.
Анализ динамики сывороточной концентрации провоспалительных цитокинов IL-6 и TNF-α показал достаточно интересную картину. Наблюдавшиеся изначально повышенные уровни IL-6 и TNF-α, по всей видимости, указывают на более выраженную воспалительную реакцию у пациенток с НГЭ. После хирургического вмешательства вполне ожидаемо отмечено существенное увеличение данных показателей. Однако клинико-лабораторное исследование показало несколько иные результаты. Динамика IL-6 у пациенток с НГЭ или другими доброкачественными заболеваниями соответствовала ожиданиям, и наблюдаемое увеличение концентрации IL-6 в 1-ю неделю после операции вполне соотносится с повреждением тканей и органов вследствие проведенного лечения. В результате проявления травмирующей компоненты хирургического вмешательства в 1-ю неделю после терапии развитие воспаления, вероятно, соотносилось с высвобождением молекулярных паттернов, связанных с повреждением (англ. damage-associated molecular patterns, DAMPs), инициирующих провоспалительные сигнальные пути [20]. При этом снижение сывороточной концентрации IL-6 на 3-й месяц после операции соотносится с уменьшением влияния травмирующего фактора хирургического вмешательства и самой нозологии. Однако слабая выраженность наблюдаемых изменений несколько снижает их клиническую значимость.
В свою очередь, динамика концентрации TNF-α у пациенток с НГЭ принципиально отличалась от таковой у женщин с другими доброкачественными гинекологическими патологиями. Так, проведение хирургического лечения способствовало выраженному снижению данного показателя в течение всего наблюдения, в т.ч. через 1 нед после операции. Такой характер изменений существенно отличался от наблюдаемой динамики концентрации TNF-α у пациенток группы сравнения, где она была сопоставима с динамикой уровня IL-6. На основании полученных результатов можно выдвинуть предположение о существенной роли TNF-α в развитии НГЭ, при этом выраженность данного влияния значительно превышает таковую у IL-6. В то же время дизайн нашего исследования не предполагал сравнительного изучения молекулярных механизмов реализации активности биомаркеров воспаления, и требуется проведение дополнительных исследований для понимания природы данных изменений.
Проведенное исследование показало существенное снижение выраженности воспалительного ответа, оцененного по величине NLR и концентрации CitH3, у пациенток с НГЭ. Оценка динамики данных показателей в некоторой степени сочеталась с динамикой уровня IL-6, а именно с существенным увеличением через 1 нед после хирургического лечения и последующим снижением спустя 3 мес после операции. Однако в данном случае можно с достаточной уверенностью говорить о значимом снижении величины NLR и концентрации CitH3 по сравнению с исходными значениями. Интересной представляется динамика концентрации CitH3 у пациенток с НГЭ. В отличие от всех изученных в нашем исследовании биомаркеров течения воспалительного процесса, только CitH3 снизился до уровня, сопоставимого с показателем у почти здоровых женщин. Данный факт позволяет рассматривать CitH3 не только как диагностический биомаркер, как это представлено в клинических исследованиях, посвященных изучению злокачественных новообразований репродуктивных органов, но и как биомаркер оценки эффективности проведенного хирургического лечения и ведения пациенток с НГЭ на восстановительном этапе [21–23].
Таким образом, основываясь на полученных результатах, можно констатировать развитие воспалительного процесса у женщин с НГЭ. Наблюдаемое воспаление соотносится с наличием гинекологического заболевания и поддается коррекции путем хирургического вмешательства. Среди всех оцененных биомаркеров отмечена высокая значимость CitH3 в оценке качества лечения и ведения пациенток на этапе реабилитации.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Ведение пациенток гинекологического профиля, перенесших радикальное хирургическое лечение, на восстановительном этапе является одной из сложнейших задач для врачей-реабилитологов. Подбор оптимальной стратегии реабилитации и инструментов мониторинга состояния здоровья до сих пор остается целью многочисленных исследований в данной области.
Проведенное исследование позволило выявить значимость воспалительного процесса у женщин с НГЭ. Показана возможность осуществления коррекции патологического процесса путем проведения хирургического вмешательства, на что указала характерная динамика ряда оцениваемых биомаркеров воспаления. Выраженное снижение сывороточной концентрации CitH3 у больных с НГЭ после операции до уровня показателей у почти здоровых женщин указывает на перспективность использования данного биомаркера в оценке качества проведенного лечения и мониторинга состояния здоровья пациенток на восстановительном этапе.
1. https://cr.minzdrav.gov.ru/.
Список литературы
1. Солопова А.Г., Ачкасов Е.Е., Москвичёва В.С. и др. Наружный генитальный эндометриоз: вопросы лечения и реабилитации. Акушерство, гинекология и репродукция. 2021; 15 (1): 70-9. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.148.
2. Санджиева Л.Н., Галкин В.Н., Блинов Д.В., Солопова А.Г. Влияние реабилитации на качество жизни после радикального лечения рака эндометрия и атипической гиперплазии эндометрия. Реабилитология. 2024; 1 (1): 5-17. https://doi.org/10.17749/2949-5873/rehabil.2023.1.
3. Eisenberg V.H., Weil C., Chodick G., Shalev V. Epidemiology of endometriosis: a large population-based database study from a healthcare provider with 2 million members. BJOG. 2018; 125 (1): 55-62. https://doi.org/10.1111/1471-0528.14711.
4. Pugsley Z., Ballard K. Management of endometriosis in general practice: the pathway to diagnosis. Br J Gen Pract. 2007; 57 (539): 470-6.
5. Ballard K.D., Seaman H.E., de Vries C.S., Wright J.T. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study - Part 1. BJOG. 2008; 115 (11): 1382-91. https://doi.org/10.1111/j.1471-0528.2008.01878.x.
6. Abbas S., Ihle P., Koster I., Schubert I. Prevalence and incidence of diagnosed endometriosis and risk of endometriosis in patients with endometriosis-related symptoms: findings from a statutory health insurance-based cohort in Germany. Eur J Obstet Gynecol Reprod Biol. 2012; 160 (1): 79-83. https://doi.org/10.1016/j.ejogrb.2011.09.041.
7. Rogers P.A.W., D'Hooghe T.M., Fazleabas A., et al. Priorities for endometriosis research: recommendations from an international consensus workshop. Reprod Sci. 2009; 16 (4): 335-46. https://doi.org/10.1177/1933719108330568.
8. Эндометриоз. Всемирная организация здравоохранения. URL: https://www.who.int/ru/news-room/fact-sheets/detail/endometriosis (дата обращения 12.03.2024). Endometriosis. World Health Organization. Available at: https://www.who.int/news-room/fact-sheets/detail/endometriosis (accessed 12.03.2024).
9. Cho S., Cho H., Nam A., et al. Neutrophil-to-lymphocyte ratio as an adjunct to CA-125 for the diagnosis of endometriosis. Fertil Steril. 2008; 90 (6): 2073-9. https://doi.org/10.1016/j.fertnstert.2008.03.061.
10. Tokmak A., Yildirim G., Ozta§ E., et al. Use of neutrophil-to-lymphocyte ratio combined with CA-125 to distinguish endometriomas from other benign ovarian cysts. Reprod Sci. 2016; 23 (6): 795-802. https://doi.org/10.1177/1933719115620494.
11. Turgut A., Hocaoglu M., Ozdamar O., et al. Could hematologic parameters be useful biomarkers for the diagnosis of endometriosis? Bratisl Lek Listy. 2019; 120 (12): 912-8. https://doi.org/10.4149/BLL_2019_153.
12. Seckin B., Ates M.C., Kirbas A., Yesilyurt H. Usefulness of hemato-logical parameters for differential diagnosis of endometriomas in adolescents/young adults and older women. Int J Adolesc Med Health. 2018; 33 (2). https://doi.org/10.1515/ijamh-2018-0078.
13. Vigano P., Ottolina J., Sarais V., et al. Coagulation status in women with endometriosis. Reprod Sci. 2018; 25 (4): 559-65. https://doi.org/10.1177/1933719117718273.
14. Yavuzcan A., ^aglar M., Ustun Y., et al. Evaluation of mean platelet volume, neutrophil/lymphocyte ratio and platelet/lymphocyte ratio in advanced stage endometriosis with endometrioma. J Turk Ger Gynecol Assoc. 2013; 14 (4): 210-5. https://doi.org/10.5152/jtgga.2013.55452.
15. Сорокина А.В. Эндометриоз. Медицинская сестра. 2010; 8: 21-2. Sorokina A.V. Endometriosis. Meditsinskaya sestra / The Nurse. 2010; 8: 21-2 (in Russ.).
16. Мягченкова К.И., Хащенко Е.П., Уварова Е.В. Психоэмоциональные особенности и болевая симптоматика у пациенток, страдающих генитальным эндометриозом в раннем репродуктивном возрасте. Репродуктивное здоровье Детей и подростков. 2021; 17 (2): 41-50. https://doi.org/10.33029/1816-2134-2020-17-2-41-50.
17. Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril. 1997; 67 (5): 817-21. https://doi.org/10.1016/s0015-0282(97)81391-x.
18. Manolescu B.N., Berteanu M., Dumitru L., et al. Dynamics of inflammatory markers in post-acute stroke patients undergoing rehabilitation. Inflammation. 2011; 34 (6): 551-8. https://doi.org/10.1007/s10753-010-9262-8.
19. Yeh T.T., Hsieh Y.W., Wu C.Y., et al. A preliminary investigation of the association of sleep with inflammation and oxidative stress biomarkers and functional outcomes after stroke rehabilitation. Sci Rep. 2017; 7 (1): 8634. https://doi.org/10.1038/s41598-017-08931-w.
20. Roh J.S., Sohn D.H. Damage-associated molecular patterns in inflammatory diseases. Immune Netw. 2018; 18 (4): e27. https://doi.org/10.4110/in.2018.18.e27.
21. Ronchetti L., Terrenato I., Ferretti M., et al. Circulating cell free DNA and citrullinated histone H3 as useful biomarkers of NETosis in endometrial cancer. J Exp Clin Cancer Res. 2022; 41 (1): 151. https://doi.org/10.1186/s13046-022-02359-5.
22. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток. Акушерство, гинекология и репродукция. 2023; 17 (1): 53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385.
23. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы. Акушерство, гинекология и репродукция. 2022; 16 (4): 426-37. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335.
Об авторах
Б. БайгалмааМонголия
Байгалмаа Балдансамбуу
Улан-Батор
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., проф. РАН
ул. Трубецкая, д. 8, стр. 2, Москва 119991
WoS ResearcherID: F-8409-2017. Scopus Author ID: 6506003478
А. Е. Ефанов
Россия
Ефанов Александр Евгеньевич
ул. Саляма Адиля, д. 2/44, Москва 123423
А. Е. Войновский
Россия
Войновский Александр Евгеньевич, д.м.н., проф.
ул. Саляма Адиля, д. 2/44, Москва 123423
WoS ResearcherID: S-6385-2016
Рецензия
Для цитирования:
Байгалмаа Б., Бицадзе В.О., Ефанов А.Е., Войновский А.Е. Динамическая оценка содержания маркеров воспаления в крови пациенток в периоде реабилитации после хирургического лечения наружного генитального эндометриоза. Реабилитология. 2024;2(3):286-294. https://doi.org/10.17749/2949-5873/rehabil.2024.26
For citation:
Baigalmaa B., Bitsadze V.O., Efanov A.Е., Voynovskiy A.Е. Dynamic assessment of blood inflammation markers in patients during the rehabilitation period after surgical treatment for external genital endometriosis. Journal of Medical Rehabilitation. 2024;2(3):286-294. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.26






