Перейти к:
Перспективные биомаркеры нарушения проницаемости гематоэнцефалического барьера в реабилитации детей с перинатальным гипоксическиишемическим поражением центральной нервной системы
https://doi.org/10.17749/2949-5873/rehabil.2024.9
Аннотация
Актуальность. Диагностика, лечение и реабилитация новорожденных с повреждением тканей центральной нервной системы (ЦНС) являются актуальной проблемой современного медицинского сообщества. Ранняя диагностика гипоксически-ишемических нарушений ЦНС – ключевой элемент в стратегии ведения новорожденных с выявленной асфиксией. Поиск чувствительных и специфичных диагностических инструментов позволит улучшить прогноз исхода заболевания и эффективность проводимой реабилитации.
Цель: выделить перспективные сывороточные биомаркеры повреждения тканей головного мозга для скрининга и мониторинга состояния новорожденных.
Материал и методы. Поиск публикаций проведен автоматически в научных базах данных PubMed/MEDLINE, Google Scholar, ScienceDirect и электронной библиотеке eLibrary, а также вручную в поисковых системах Яндекс, Google. Последующий отбор исследований выполнен с учетом рекомендаций PRISMA. Из обнаруженных 3778 публикаций в обзор включены 52.
Результаты. Представлены перспективные биомаркеры повреждения головного мозга, определяемые в сыворотке крови у новорожденных: дипептидилпептидаза-4, ряд цитокинов, нейронспецифичная енолаза (НСЕ), бутилкарнитин, кальций-связывающий белок B S100 (S100B), F2-изопростаны, ядросодержащие эритроциты, а также некоторые другие биомаркеры, изменение уровня которых коррелировало с выраженностью нарушения тканей ЦНС.
Заключение. Дисфункция гематоэнцефалического барьера вызывает появление в сыворотке крови высокоспецифичных белков повреждения нейронов и глии, в частности S100B и НСЕ, которые можно определить как биомаркеры. Необходимо расширять доказательную базу и валидацию использования указанных биомаркеров с целью последующего внедрения в клинические рекомендаций по ведению пациентов с повреждением тканей ЦНС в раннем постнатальном периоде для своевременной диагностики и коррекции реабилитационных мероприятий.
Ключевые слова
Для цитирования:
Александров А.Г., Петренко Д.А. Перспективные биомаркеры нарушения проницаемости гематоэнцефалического барьера в реабилитации детей с перинатальным гипоксическиишемическим поражением центральной нервной системы. Реабилитология. 2024;2(2):207-215. https://doi.org/10.17749/2949-5873/rehabil.2024.9
For citation:
Aleksandrov A.G., Petrenko D.A. Promising biomarkers of blood-brain barrier permeability impairment in rehabilitation of infants with perinatal hypoxic-ischemic central nervous system injury. Journal of Medical Rehabilitation. 2024;2(2):207-215. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.9
ВВЕДЕНИЕ / INTRODUCTION
Возникновение перинатальных гипоксически-ишемических повреждений центральной нервной системы (ЦНС) у новорожденных являются крайне актуальной проблемой для медицинского сообщества, т.к. представляют собой одну из наиболее частых причин заболеваемости и смертности детей неонатального периода и раннего возраста [1–3]. Ввиду еще не сформировавшейся системы антиоксидантной защиты головной мозг (ГМ) плода и новорожденного особенно уязвим к многочисленным эндо- и экзогенным факторам, приводящим к окислительному стрессу с образованием свободных радикалов. Дисбаланс гомеостаза антиоксидантных систем возникает при рождении у всех новорожденных как следствие гипероксического воздействия при переходе от внутриутробной среды с пониженной концентрацией кислорода к внеутробной жизни [4][5]. В еще большей степени подвержены патологическому действию свободных радикалов нейрональные структуры недоношенных детей [6].
Поиск более точных диагностических инструментов для выявления повреждений структур ГМ привел к исследованиям ряда биомаркеров неонатального повреждения ГМ, обнаруживающихся в сыворотке крови при повышении проницаемости гематоэнцефалического барьера (ГЭБ) [7][8]. ГЭБ – сложная защитно-регуляторная структура ГМ, нейроваскулярная единица которого представлена эндотелием капилляров ГМ, астроцитами, нейронами, перицитами [8]. Плотные межклеточные контакты между эндотелиоцитами позволяют обеспечивать избирательную проницаемость ГЭБ. В случае ишемического или инфекционного поражения ГМ неотъемлемым компонентом патогенеза становится нарушение проницаемости ГЭБ: разрушаются плотные межклеточные контакты и происходит дисрегуляция активности транспортных белков. Вследствие этого ГЭБ перестает быть препятствием для прохождения молекул из системного кровотока как в ГМ, так и в обратном направлении [8–10].
Резкое патологическое увеличение проницаемости называется «прорывом» ГЭБ и приводит к попаданию в сосудистое русло нейроспецифичных белков (НСБ), которые в норме не обнаруживаются в крови. Таким образом, НСБ можно использовать в качестве периферических маркеров повреждения ГЭБ с целью улучшения диагностики с последующей своевременной коррекцией реабилитационных мероприятий [5][9][11].
Цель – выделить перспективные сывороточные биомаркеры повреждения тканей ГМ для скрининга и мониторинга состояния новорожденных.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Поиск публикаций проведен автоматическим и ручным способами. Автоматический поиск выполняли в международных научных базах данных PubMed/MEDLINE, ScienceDirect, Google Scholar, а также в электронной библиотеке eLibrary. Глубина автоматического поиска составила 20 лет. Ручной поиск осуществлен каждым исследователем отдельно в поисковых системах Google и Яндекс. Критерием отбора исследований являлась релевантность публикации заявленной цели обзора.
Использовали ключевые слова и словосочетания на русском и английском языках: «гипоксически-ишемическое повреждение», «головной мозг», «биомаркеры», «сыворотка», “hypoxic ischemic injury”, “brain”, “biomarkers”, “serum”. Затем отсеивали публикации, не связанные с новорожденными, с помощью запросов «новорожденные», “newborn”, а также исследования, которые не относились к клиническим, с помощью ключевых слов «животные», «мыши», «крысы», “animal”, “mice”, “rat”.
Отбор исследований / Selection of publications
Отбор исследований осуществлен с учетом рекомендаций PRISMA [12] (рис. 1). Всего обнаружено 3778 публикаций по изучению биомаркеров повреждения ГМ. После отбора работ, посвященных только новорожденным, в дальнейший анализ было включено 1152 статьи. Примечательно, что в результаты поиска попадали неклинические исследования, что, вероятно, связано с достаточным количеством испытаний на лабораторных животных. По всей видимости, в таких исследованиях слово “newborn” используют по отношению к потомству лабораторных животных. После введения дополнительного оператора поиска NOT с добавлением слов, позволяющих отсеять исследования на животных, данная проблема была решена.
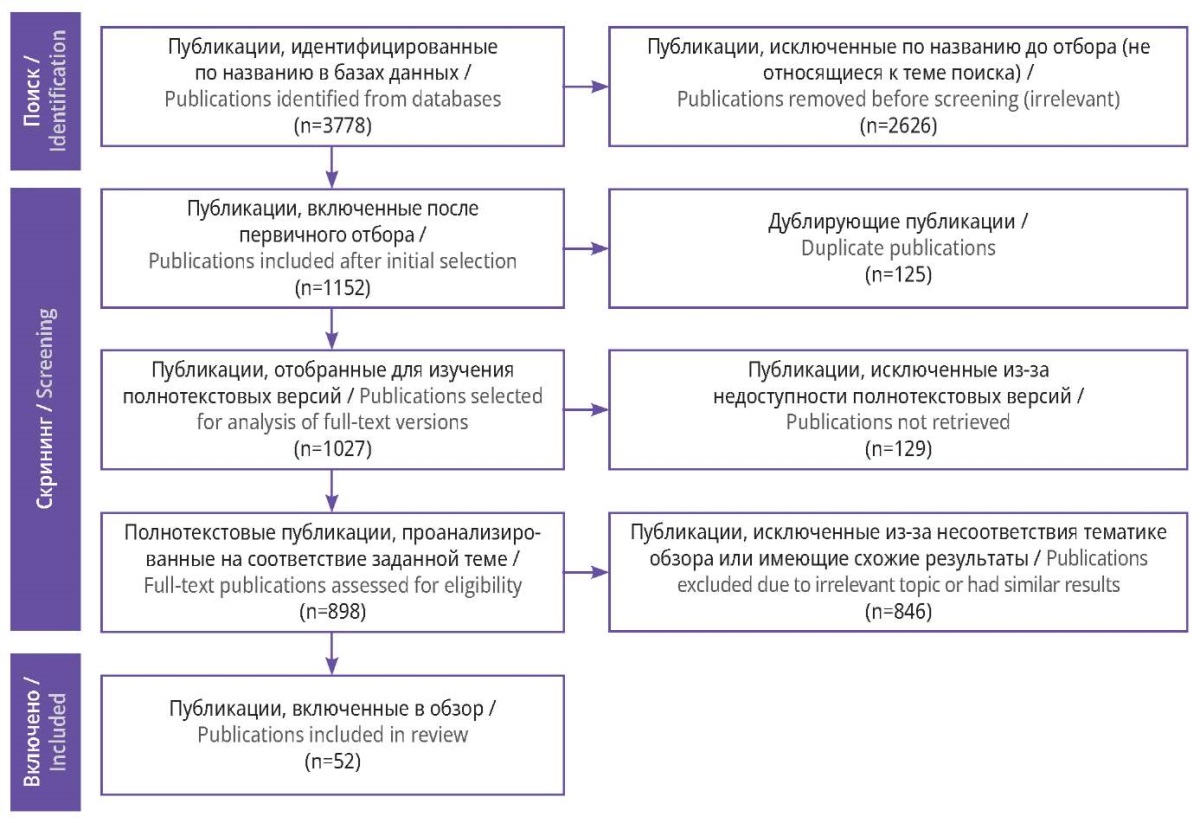
Рисунок 1. Блок-схема отбора публикаций с учетом рекомендаций PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews
and Meta-Analyses) workflow for selection of publications
На следующем этапе проводили отсев дублирующих публикаций: исключено 125 статей. Остальные источники проверяли на предмет наличия полнотекстовой версии. Среди всех работ только в 898 случаях был найден полный текст, либо представленный PDF-файлом, либо размещенный на странице сайта. Публикации, полученные из сомнительного источника, нерелевантные или дублирующие результаты других исследований, из обзора исключались. Проведенный отбор позволил вы-
явить в общей сложности 52 работы, которые затрагивали тему биомаркеров повреждения ГМ у новорожденных, являлись релевантными, уникальными по представленным результатам и были получены из авторитетных источников.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Повреждения ГМ у недоношенных новорожденных / Brain damage in premature newborns
Преждевременные роды прерывают процесс созревания ГМ, вызывая задержку нервного развития и другие патологии ЦНС в постнатальном периоде. Внутрижелудочковое кровоизлияние (ВЖК), возникающее при повреждении зародышевого матрикса и субвентрикулярной зоны, поражает 20–25% недоношенных новорожденных с массой тела при рождении менее 1500 г [13]. Это связано с незрелостью кровеносных сосудов зародышевого матрикса, высоковаскуляризированной области ГМ, в сочетании с недостаточно сформированными окружающими тканями. Кроме того, перивентрикулярный геморрагический инфаркт, при котором кровоизлияние затрагивает и паренхиматозную ткань, рассматривается как следствие указанных морфофункциональных изменений тканей ГМ.
ВЖК у новорожденных может иметь различные проявления – от острого ухудшения состояния с апноэ, бледностью, ацидозом, гипотензией, выбуханием родничка, судорогами и снижением мышечного тонуса до «клинически молчаливого синдрома», когда отсутствуют симптомы патологии [5][13].
Еще одним важным проявлением поражения ЦНС у недоношенных новорожденных выступает перивентрикулярная лейкомаляция (ПВЛ) – повреждение белого вещества ГМ, связанное с уменьшением коры, таламуса и базальных ганглиев. Изначально образуется очаг некроза нейронов, реактивного глиоза и активации микроглии – все это может в течение нескольких недель перерасти в множественные кистозные поражения (так называемая кистозная ПВЛ). Однако чаще всего очаговый некроз является микроскопическим и переходит в глиальные рубцы, сложно распознаваемые при нейровизуализации [14][15]. ПВЛ провоцирует детский церебральный паралич (ДЦП), когнитивный, поведенческий дефицит и дефицит внимания. Такие методы диагностики, как ультразвуковое исследование (УЗИ) и магнитно-резонансная томография (МРТ), имеют ряд ограничений, связанных с объективностью интерпретации изображения и сложностью выполнения МРТ из-за критического клинического состояния младенцев в первые недели жизни, а также потребности в надлежащей седации новорожденного [16].
ДЦП – группа стабильных нарушений развития моторики и поддержания позы, ведущих к двигательным дефектам, обусловленным непрогрессирующим повреждением и/или аномалией развивающегося ГМ у плода или новорожденного ребенка [17]. Диагноз ДЦП может быть поставлен в первые 6 мес жизни и основан на клинической картине в сочетании с другими диагностическими инструментами, такими как нейровизуализация (УЗИ и МРТ) и раннее стандартизированное двигательное/неврологическое обследование. Несмотря на развитие медицинских технологий за последнее десятилетие, заболеваемость ДЦП среди недоношенных детей остается высокой и поздно верифицируемой, что снижает эффективность реабилитации таких пациентов. Инновационный метод в виде быстрого скринингового теста на сывороточные биомаркеры может иметь решающее значение для своевременной диагностики, реабилитации и улучшения неврологических исходов в этой группе больных [18].
Повреждения ГМ у доношенных новорожденных / Brain damage in full-term newborns
Основными причинами поражения ГМ у доношенных новорожденных являются гипоксически-ишемическая энцефалопатия (ГИЭ), неонатальный инсульт и системные инфекции [19]. Хотя терапевтическая гипотермия в качестве «золотого стандарта» лечения ГИЭ существенно улучшила прогноз исхода заболевания, этот подход можно начинать только у доношенных новорожденных в первые 6 ч жизни [20][21]. Данный способ имеет лишь частичную эффективность, поскольку 45% пациентов все же умирают или имеют нарушения нервно-психического развития, несмотря на проводимое лечение [22].
Первая стадия ГИЭ характеризуется энергетическим дефицитом вследствие гипоксической ишемии, вторая – окислительным метаболизмом с активацией воспалительного и апоптотического каскадов вследствие реперфузии ишемизированной зоны. Все это вызывает увеличение активности липаз, протеаз и эндонуклеаз и продукцию свободных жирных кислот (особенно арахидоновой), повышение активности циклооксигеназы и образование простагландинов, а также высвобождение протеазами супероксидных свободных радикалов, что приводит к поддержанию активного воспалительного каскада [22][23]. Запущенный «порочный круг» способствует дальнейшему высвобождению свободных радикалов и других токсических метаболитов, которые в определенный момент превышают возможности антиоксидантной защиты клеток нивелировать их негативное влияние. Наконец, третья стадия ГИЭ – период после гипоксического инсульта, продолжающийся от нескольких месяцев до нескольких лет, во время которого наблюдается реактивный глиоз с персистирующим воспалением и эпигенетическими изменениями [24][25].
Другой причиной возникновения краткосрочного повреждения ГМ является инсульт, поражающий как артериальные, так и венозные сосуды, с геморрагическим, ишемическим или смешанным компонентом [26–28]. Основное клиническое проявление инсульта – судороги в первые недели жизни [27][29]. Долгосрочные последствия данного поражения представлены эпилептическим синдромом, ДЦП, врожденной гемиплегией, задержкой нервного развития, включая умственную отсталость, задержкой речи и поведенческими отклонениями от младенчества до взрослой жизни.
Важную роль в патологиях ЦНС в неонатальном периоде играют внутриутробные инфекции, в частности инфекции группы TORCH (англ. Toxoplasma – токсоплазменная инфекция, Rubella – краснуха, Cytomegalovirus – цитомегаловирус, Herpes – герпес). В частности, цитомегаловирусная инфекция провоцирует нарушения развития ЦНС и негенетическую сенсорную тугоухость [30].
Таким образом, в целях увеличения точности и сокращения времени постановки диагноза, указывающего на повреждение тканей ЦНС у новорожденных, необходимо разрабатывать и оптимизировать существующие инструменты диагностики. Среди множества разработанных методов наиболее перспективным представляется определение биомаркеров повреждения ГМ в сыворотке крови.
Биомаркеры повреждения тканей ЦНС, вызванного асфиксией или ишемией ГМ у новорожденных / Biomarkers of CNS tissue damage caused by asphyxia or cerebral ischemia in newborns
Существует множество биомаркеров, которые изучают с целью поиска взаимосвязи между их наличием или изменением концентрации и фактом повреждения тканей ЦНС у новорожденных.
Дипептидилпептидаза-4
Дипептидилпептидаза-4 (ДПП-4) представляет собой мембраносвязанную сериновую протеазу, которая локализуется в желудочно-кишечном тракте, печени, легких, почках, а также на Т-лимфоцитах, где фермент известен как маркер активации CD26. ДПП-4 и ДПП-4-подобные пептидазы из семейства пролилолигопептидаз гидролизуют нейропептиды, цитокины и пептидные гормоны [5][31]. Предполагается, что эти ферменты могут быть связаны с нарушением целостности структур ГМ, ассоциированным с ишемией. Участие ДПП-4 в процессах воспаления и повреждения нервной ткани при ишемическом поражении ГМ было показано на животных [32].
По данным A.A. Yakovleva et al. [33], активность ДПП-4 в сыворотке крови у новорожденных с ишемией ГМ была значительно выше, чем у новорожденных в контрольной группе. Кроме того, у недоношенных и доношенных детей не наблюдалось различий в уровне активности ДПП-4 при гипоксии. Авторы отметили, что среди доношенных новорожденных с церебральной ишемией максимальная активность ДПП-4 была выявлена у пациентов с синдромом возбуждения и была значительно выше, чем у детей с депрессивным синдромом. Вместе с тем среди недоношенных детей с церебральной ишемией и различной функциональной активностью нервной системы не отмечено значимых различий в активности ДПП-4 в сыворотке [33].
Можно предположить, что ДПП-4 принимает участие в регуляции деятельности ЦНС у доношенных новорожденных. Напротив, у недоношенных детей эти регуляторные механизмы все еще находятся в стадии развития. Известно, что ДПП-4 участвует в передаче сигнала активации Т-хелперов, что приводит к их пролиферации и продукции цитокинов [34]. Поэтому гипоксию можно считать индуктором воспалительной реакции, определяющей повышение активности ДПП-4 в крови у новорожденных [35][36].
Таким образом, определение уровня ДПП-4 в сыворотке крови у новорожденных может стать эффективным инструментом скрининга наличия изменений структур ГМ, обусловленных ишемией.
Цитокины
Гипоксически-ишемическое повреждение активирует многие воспалительные каскады в ЦНС. Было высказано предположение, что ряд воспалительных молекул являются сигнальными биомаркерами ГИЭ, которые достаточно легко измерить путем анализа периферической крови и сопоставить с фазами повреждения при ГИЭ [37].
Микроглия − это резидентные иммунные клетки ГМ, принимающие участие как в защите нейронов от различных факторов, так и в воспалительном ответе ЦНС. В условиях ГИЭ микроглия в избытке вырабатывает провоспалительные цитокины, например фактор некроза опухоли альфа (ФНО-α) и интерлейкин 1β (ИЛ-1β), а также глутамат, оксид азота (NO), активные формы кислорода, вызывающие гибель олигодендроцитов, дегенерацию аксонов и нарушение незрелого ГЭБ [38]. Провоспалительные цитокины могут активировать патологические изменения в развивающемся белом веществе ГМ у новорожденных, индуцируя внутрисосудистое свертывание, тромбоз и вазоконстрикцию, выработку других цитокинов, таких как фактор активации тромбоцитов.
В 2003 г. С. Chiesa et al. [39] сообщили, что ИЛ-6 является информативным диагностическим маркером ГИЭ и задержки нервно-психического развития. Много лет спустя V. Chaparro-Huerta et al. [40] подтвердили эти результаты, показав более высокие уровни ИЛ-6 у пациентов с гипоксией при рождении. Кроме того, было продемонстрировано, что экспрессия генов, кодирующих ФНО-α и ИЛ-1β, увеличивалась в несколько раз у младенцев, страдающих ГИЭ, по сравнению со здоровыми детьми, а экспрессия генов ИЛ-6 повышалась в девять раз [40].
Исследование S. Fotopoulos et al., результаты которого согласуются с более поздними работами, продемонстрировало, что у новорожденных с выявленной асфиксией при родах уровни ИЛ-6 и ИЛ-1β в сыворотке были значительно выше, чем у здоровых детей. Напротив, сывороточные уровни ФНО-α не различались между двумя группами новорожденных [41].
Нейронспецифическая енолаза
Нейронспецифическая енолаза (НСЕ) – высокоспецифичный фермент гликолиза нейронов и периферических нейроэндокринных клеток [42][43]. Так же как ДПП-4 и провоспалительные цитокины, уровень НСЕ существенно нарастал у когорты новорожденных с ГИЭ и асфиксией по сравнению с когортой здоровых детей в ряде клинических исследований [40][44–46]. В упомянутой выше работе V. Chaparro-Huerta et al. [40] выявлена корреляция между уровнем НСЕ в сыворотке крови с тяжестью энцефалопатии и повреждения ГМ. Эти данные согласуются с результатами С. Çeltik et al. [44], D. Giuseppe et al. [45], О. López-Suárez et al. [46]. В свою очередь, N. Nagdyman et al. [47] в схожем исследовании не обнаружили различий в уровне НСЕ у 29 новорожденных с асфиксией и 20 здоровых младенцев.
Бутирилкарнитин
Окисление жирных кислот, также именуемое β-окислением, происходит в митохондриях с участием по меньшей мере 31 фермента или белка-транспортера. Короткоцепочечная ацил-КоА-дегидрогеназа представляет собой фермент, катализирующий первую фазу β-окисления митохондриальных жирных кислот. Повышение уровня бутирилкарнитина является результатом дисфункции этого фермента [5].
В ретроспективном наблюдательном когортном исследовании, проведенном О. López-Suárez et al. [46], был проанализирован ацетилкарнитиновый профиль 67 детей с ранней ГИЭ в перинатальном периоде (1–7-й дни жизни) с целью соотнесения данного профиля с исходом заболевания. В результате обнаружена значительная положительная корреляция между уровнем бутирилкарнитина и НСЕ в сыворотке крови, особенно в 1-й день лечения гипотермией (р=0,002), и изменениями, выявленными в ГМ по данным МРТ при выписке (р=0,037). Следует отметить, что концентрация бутирилкарнитина снижалась у пациентов с благоприятным исходом, в то время как высокие уровни данного биомаркера соотносились с неблагоприятным прогнозом и прогрессированием патологии [46].
Таким образом, бутирилкарнитин, по-видимому, является перспективным прогностическим биомаркером повреждения нейронов при ГИЭ.
Кальций-связывающий белок B S100
Кальций-связывающий белок B S100 (S100B) – один из наиболее широко изученных биологических маркеров повреждения ГМ. В физиологическом состоянии ЦНС он встречается в цитоплазме, а также в ядрах астроцитов. S100B участвует в регулировании уровня кальция, пролиферации клеток, фосфорилировании и деградации белков.
Высвобождение S100B продемонстрировано в эксперименте in vitro при повреждении культуры клеток глии и нейронов [48]. Кроме того, в рекомендациях Скандинавского комитета нейротравматологии (англ. Scandinavian Neurotrauma Committee, SNC) по начальному лечению минимальных, легких и умеренных травм головы у взрослых предлагается включать измерение уровня S100B в качестве инструмента скрининга для принятия решения о проведении компьютерной томографии [7].
Белок S100B начинает секретироваться глией в ответ на метаболическое повреждение и высвобождается в биологические жидкости (ликвор, кровь, моча, слюна, околоплодные воды) на самых ранних стадиях. Обзор F. Michetti et al. [49] обобщил доступные литературные данные относительно чувствительности и специфичности тестирования S100B в моче и сыворотке (временные точки мониторинга до 24 ч) при патологии. Определение уровня S100B в сыворотке крови показало чувствительность от 50% до 73% и специфичность от 74% до 90% в отношении повреждения структур ГМ [49].
Кальций-связывающий белок при физиологических концентрациях выполняет трофическую роль в процессе развития нервной системы, однако его чрезмерная экспрессия может иметь опасные последствия из-за активации индуцибельной NO-синтазы и последующей продукции NO с гибелью астроцитов [50]. Именно на ранней стадии гипоксии концентрация S100B увеличивается как в спинномозговой жидкости, так и в пуповинной крови. V. Chaparro-Huerta et al. методом полимеразной цепной реакции обнаружили существенное увеличение (на 97%) экспрессии генов, кодирующих S100B, в лейкоцитах венозной крови детей с энцефалопатией по сравнению со здоровыми новорожденными [40].
Содержание S100B в сыворотке увеличивается пропорционально тяжести ГИЭ, поражения белого вещества ГМ: при тяжелой асфиксии уровень S100B оказывается высоким сразу после рождения и продолжает расти в течение недели, при легкой форме он лишь незначительно повышается вскоре после рождения и далее снижается [5][51]. При этом у младенцев без признаков асфиксии всегда наблюдаются базовые физиологические уровни белка [52].
Следовательно, определение сывороточной концентрации S100B сразу после рождения позволяет дать прогностическую оценку клинического исхода для новорожденных с асфиксией. Интересно, что заметное повышение уровня белка было обнаружено также у доношенных и недоношенных младенцев с асфиксией, осложненной ВЖК [53][54].
Исследования взаимосвязи уровня S100B и течения патологии продемонстрировали, что более высокие концентрации S100B при беременности с задержкой развития плода указывают на хроническую гипоксию [55]. Поэтому данный белок можно использовать в качестве биомаркера повреждения ГМ у новорожденных с фетальной задержкой развития [51]. D. Gazzolo et al. выявили, что более высокие уровни S100B наблюдались у матерей c задержкой развития плода, у детей которых после рождения развилось ВЖК [56].
Чтобы соответствовать критериям надежного использования S100B в качестве точного скринингового теста, для улучшения прогнозирования результатов могут потребоваться комбинации биомаркеров. Например, сочетание S100B с НСЕ повышает точность раннего выявления повреждений нейронов.
Таким образом, оценка уровня S100B может стать точным прогностическим инструментом, позволяющим выявить риск развития процессов, сопровождающихся поражением ГМ, как на перинатальном этапе, так и в постнатальном периоде развития.
F2-изопростаны
F2-изопростаны (F2-ИП) образуются в результате перекисного окисления липидов (ПОЛ) клеточных мембран вследствие воздействия повреждающих факторов. Белое вещество ГМ недоношенных новорожденных в период между 23-й и 32-й неделями крайне уязвимо к реакциям ПОЛ. Соответственно, можно предположить наличие диагностической значимости F2-ИП как маркеров ПОЛ [57].
M.A. Matthews et al. [58] собрали образцы плазмы крови у 121 недоношенного ребенка на 14-й и 28-й дни после рождения с целью определить прогностическую способность F2-ИП в отношении развития респираторных изменений и повреждения тканей ЦНС. Была составлена регрессионная модель, согласно которой каждое увеличение F2-ИП на 50 единиц прогнозировало снижение когнитивных, коммуникативных и двигательных показателей на 1,9, 1,2 и 2,4 балла соответственно (р<0,001) [58].
В исследовании С. Coviello et al. [59], включавшее 39 пациентов с гестационным возрастом менее 28 нед, изучена возможность использования F2-ИП в качестве биомаркера повреждения ГМ у младенцев. Авторы обнаружили связь между высокими уровнями F2-ИП на 2-е сутки после родов и снижением функциональной активности мозга [59]. Указанные результаты согласуются с данными M.A. Matthews et al. [58]. В более раннем исследовании группы С. Coviello et al. [60], проведенном на 60 недоношенных новорожденных, F2-ИП показал себя как биомаркер, позволяющий выявить наличие повреждения белого вещества c чувствительностью 86% и специфичностью 60% при уровне биомаркера выше 31,8 пг/мл.
Таким образом, измерение концентрации F2-ИП на этапе скрининга помогает выявить патологические изменения структур ГМ у новорожденных, что позволяет рассматривать F2-ИП в качестве биомаркера.
Ядросодержащие эритроциты
Другим выявленным биомаркером повреждения ГМ являются ядросодержащие эритроциты (ЯСЭ) в периферической неонатальной крови, определяемые у новорожденных с выявленной асфиксией и/или внутриутробной инфекцией [61].
Исследование S. Fotopoulos et al. [41] показало, что спустя 24 ч после родов абсолютное количество ЯСЭ в периферической крови у младенцев с выявленной асфиксией и/или инфекцией было значительно выше по сравнению со здоровыми новорожденными. В последующие дни отмечено существенное снижение данного показателя [41]. Эти результаты были подтверждены в работе Р. Florio et al. [62].
Таким обраом, можно согласиться с выводами авторов исследований о возможности использования ЯСЭ в качестве биомаркера повреждения ГМ.
Другие потенциальные биомаркеры
Активин является членом суперсемейства трансформирующего фактора роста β (англ. transforming growth factor beta, TGF-β), который регулирует дифференцировку и пролиферацию широкого пула клеток. Данный белок выполняет нейропротекторную функцию, и его активность увеличивается при механическом и химическом повреждении ГМ. Высокие концентрации активина А в плазме обнаружены как у недоношенных детей с ВЖК, так и у доношенных младенцев с асфиксией от умеренной до тяжелой степени [62].
В качестве биомаркеров патологии ГМ у новорожденных, измеряемых в пуповинной крови, также были предложены эритропоэтин, хемокиновый лиганд 18, 24S-гидроксихолестерин [5]. Однако для оценки возможного использования этих показателей в реальной клинической практике требуется расширение доказательной базы.
ЗАКЛЮЧЕНИЕ / CONCLUSION
ЦНС новорожденных крайне чувствительна и легко подвержена воздействию неблагоприятных факторов, способствующих развитию различных патологий ГМ. Одну из наиболее важных ролей в этой ситуации играет ПОЛ, которое особенно характерно для недоношенных младенцев. В литературе сообщается о наличии связи между биомаркерами окислительного стресса, измеряемыми в первые часы жизни, и «прорывом» ГЭБ в условиях повреждения ГМ.
При патологиях ЦНС в неонатальном периоде вследствие повышения проницаемости ГЭБ в периферической крови можно обнаружить НСБ. Определение концентрации НСБ в сыворотке крови новорожденных представляется эффективным и быстрым диагностическим методом, позволяющим своевременно обнаружить поражение ГМ и начать лечебно-реабилитационные мероприятия. Одним из наиболее изученных и перспективных сывороточных биомаркеров, относящихся к группе НСБ, является S100B.
Для совершенствования инструментов диагностики и внедрения их в реальную клиническую практику необходимо проведение большего числа исследований, посвященных биомаркерам повреждения тканей ЦНС, их корреляции с типом и тяжестью перинатального повреждения ГМ, что позволит улучшить отдаленные результаты лечения и реабилитации детей с нарушениями ЦНС.
Список литературы
1. Cao Z., Lin H., Gao F., et al. Microstructural alterations in projection and association fibers in neonatal hypoxia-ischemia. J Magn Reson Imaging. 2023; 57 (4): 1131–42. https://doi.org/10.1002/jmri.28366.
2. Stoke R., Schreiber V., Hocking K., et al. Perinatal antecedents of moderate and severe neonatal hypoxic ischaemic encephalopathy: an Australian birth cohort study. Aust N Z J Obstet Gynaecol. 2023; 63 (3): 409–17. https://doi.org/10.1111/ajo.13665.
3. Ravichandran L., Allen V.M., Allen A.C., et al. Incidence, intrapartum risk factors, and prognosis of neonatal hypoxic-ischemic encephalopathy among infants born at 35 weeks gestation or more. J Obstet Gynaecol Can. 2020; 42 (12): 1489–97. https://doi.org/10.1016/j.jogc.2020.04.020.
4. Perrone S., Santacroce A., Picardi A., Buonocore G. Fetal programming and early identification of newborns at high risk of free radical-mediated diseases. World J Clin Pediatr. 2016; 5 (2): 172–81. https://doi.org/10.5409/wjcp.v5.i2.172.
5. Perrone S., Grassi F., Caporilli C., et al. Brain damage in preterm and full-term neonates: serum biomarkers for the early diagnosis and intervention. Antioxidants. 2023; 12 (2): 309. https://doi.org/10.3390/antiox12020309.
6. Lembo C., Buonocore G., Perrone S. Oxidative stress in preterm newborns. Antioxidants. 2021; 10 (11): 1672. https://doi.org/10.3390/ antiox10111672.
7. Amoo M., Henry J., O’Halloran P.J., et al. S100B, GFAP, UCH-L1 and NSE as predictors of abnormalities on CT imaging following mild traumatic brain injury: a systematic review and meta-analysis of diagnostic test accuracy. Neurosurg REV. 2022; 45 (2): 1171–93. https://doi.org/10.1007/s10143-021-01678-z.
8. Kadry H., Noorani B., Cucullo L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 2020; 17 (1): 69. https://doi.org/10.1186/s12987-02000230-3.
9. Marchi N., Rasmussen P., Kapural M., et al. Peripheral markers of brain damage and blood-brain barrier dysfunction. Restor Neurol Neurosci. 2003; 21 (3–4): 109–21.
10. Salmina A.B., Komleva Y.K., Malinovskaya N.A., et al. Blood-brain barrier breakdown in stress and neurodegeneration: biochemical mechanisms and new models for translational research. Biochemistry. 2021; 86 (6): 746–60. https://doi.org/10.1134/S0006297921060122.
11. Osipova E.D., Semyachkina-Glushkovskaya O.V., Morgun A.V., et al. Gliotransmitters and cytokines in the control of blood-brain barrier permeability. REV Neurosci. 2018; 29 (5): 567–91. https://doi.org/10.1515/revneuro-2017-0092.
12. PRISMA 2020 statement. URL: https://www.prisma-statement.org/ prisma-2020-statement (дата обращения 27.06.2023).
13. Volpe J.J. Brain injury in premature infants: a complex amalgam of destructive and developmental disturbances. Lancet Neurol. 2009; 8 (1): 110–24. https://doi.org/10.1016/S1474-4422(08)70294-1.
14. Bauer C.M., Papadelis C. Alterations in the structural and functional connectivity of the visuomotor network of children with periventricular leukomalacia. Semin Pediatr Neurol. 2019; 31: 48–56. https://doi.org/10.1016/j.spen.2019.05.009.
15. Jimenez-Gomez A., Fisher K.S., Zhang K.X., et al. Longitudinal neurological analysis of moderate and severe pediatric cerebral visual impairment. Front Hum Neurosci. 2022; 16: 772353. https://doi.org/10.3389/fnhum.2022.772353.
16. Venkatakrishna S.S.B., Elsingergy M., Worede F., et al. Unequal cerebral magnetic resonance imaging changes in perinatal hypoxic ischemic injury of term neonates. J Comput Assist Tomogr. 2023; 47 (6): 913–8. https://doi.org/10.1097/RCT.0000000000001486.
17. Детский церебральный паралич (ДЦП). Клинические рекомендации. 2017. URL: https://rehabrus.ru/Docs/2017/06/KR_DPC.pdf (дата обращения 27.06.2023).
18. Spittle A.J., Morgan C., Olsen J.E., et al. Early diagnosis and treatment of cerebral palsy in children with a history of preterm birth. Clin Perinatol. 2018; 45 (3): 409–20. https://doi.org/10.1016/j.clp.2018.05.011.
19. Yıldız E.P., Ekici B., Tatlı B. Neonatal hypoxic ischemic encephalopathy: an update on disease pathogenesis and treatment. Expert REV Neurother. 2017; 17 (5): 449–59. https://doi.org/10.1080/14737175.2017.1259567.
20. Thoresen M., Tooley J., Liu X., et al. Time is brain: starting therapeutic hypothermia within three hours after birth improves motor outcome in asphyxiated newborns. Neonatology. 2013; 104 (3): 228–33. https://doi.org/10.1159/000353948.
21. Shankaran S., Laptook A.R., Ehrenkranz R.A., et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med. 2005; 353 (15): 1574–84. https://doi.org/10.1056/NEJMcps050929.
22. Azzopardi D.V., Strohm B., Edwards A.D., et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med. 2009; 361 (14): 1349–58. https://doi.org/10.1056/NEJMoa0900854.
23. Albrecht M., Zitta K., Groenendaal F., et al. Neuroprotective strategies following perinatal hypoxia-ischemia: taking aim at NOS. Free Radic Biol Med. 2019; 142: 123–31. https://doi.org/10.1016/j.00000000000freeradbiomed.2019.02.025.
24. Perrone S., Lembo C., Gironi F., et al. Erythropoietin as a neuroprotective drug for newborn infants: ten years after the first use. Antioxidants. 2022; 11 (4): 652. https://doi.org/10.3390/antiox11040652.
25. de Cerio F.G., Lara-Celador I., Alvarez A., Hilario E. Neuroprotective therapies after perinatal hypoxic-ischemic brain injury. Brain Sci. 2013; 3 (1): 191–214. https://doi.org/10.3390/brainsci3010191.
26. Lee J., Croen L.A., Backstrand K.H., et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA. 2005; 293 (6): 723–9. https://doi.org/10.1001/jama.293.6.723.
27. Sarjare S., Nedunchelian M., Ravichandran S., et al. Role of advanced (magnetic resonance) neuroimaging and clinical outcomes in neonatal strokes: experience from tertiary care center. Neuroradiol J. 2023; 36 (3): 297–304. https://doi.org/10.1177/19714009221130488.
28. Ilves N., Pajusalu S., Kahre T., et al. High prevalence of collagenopathies in pretermand term-born children with periventricular venous hemorrhagic infarction. J Child Neurol. 2023; 38 (6–7): 373–88. https://doi.org/10.1177/08830738231186233.
29. Bernson-Leung M.E., Rivkin M.J. Stroke in neonates and children. Pediatr REV. 2016; 37 (11): 463–77. https://doi.org/10.1542/pir.20160002.
30. Natale F., De Curtis M., Bizzarri B., et al. Isolated auditory neuropathy at birth in congenital cytomegalovirus infection. Ital J Pediatr. 2020; 46 (1): 3. https://doi.org/10.1186/s13052-019-0767-y.
31. Zhong J., Kankanala S., Rajagopalan S. DPP4 inhibition: insights from the bench and recent clinical studies. Curr Opin Lipidol. 2016; 27 (5): 484–92. https://doi.org/10.1097/MOL.0000000000000340.
32. Röhnert P., Schmidt W., Emmerlich P., et al. Dipeptidyl peptidase IV, aminopeptidase N and DPIV/APN-like proteases in cerebral ischemia. J Neuroinflammation. 2012; 9 (1): 44. https://doi.org/10.1186/17422094-9-44.
33. Yakovleva A.A., Zolotov N.N., Sokolov O.Y., et al. Dipeptidylpeptidase 4 (DPP4, CD26) activity in the blood serum of term and preterm neonates with cerebral ischemia. Neuropeptides. 2015; 52: 113–7. https://doi.org/10.1016/j.npep.2015.05.001.
34. Локшина Л.А. Протеиназы плазматической мембраны лимфоидных клеток и их биологические функции (обзорная статья). Биоорганическая химия. 1998; 24 (5): 323–31.
35. Malva J.O., Xapelli S., Baptista S., et al. Multifaces of neuropeptide Y in the brain – neuroprotection, neurogenesis and neuroinflammation. Neuropeptides. 2012; 46 (6): 299–308. https://doi.org/10.1016/j.npep.2012.09.001.
36. Iwai T., Sawabe T., Tanimitsu K., et al. Glucagon-like peptide-1 protects synaptic and learning functions from neuroinflammation in rodents. J Neurosci Res. 2014; 92 (4): 446–54. https://doi.org/10.1002/jnr.23335.
37. Douglas-Escobar M., Weiss M.D. Biomarkers of hypoxic-ischemic encephalopathy in newborns. Front Neurol. 2012; 3: 144. https://doi.org/10.3389/fneur.2012.00144.
38. Kaur C., Rathnasamy G., Ling E.A. Roles of activated microglia in hypoxia induced neuroinflammation in the developing brain and the retina. J Neuroimmune Pharmacol. 2013; 8 (1): 66–78. https://doi.org/10.1007/s11481-012-9347-2.
39. Chiesa C., Pellegrini G., Panero A., et al. Umbilical cord interleukin-6 levels are elevated in term neonates with perinatal asphyxia. Eur J Clin INVest. 2003; 33 (4): 352–8. https://doi.org/10.1046/j.1365-2362. 2003.01136.x.
40. Chaparro-Huerta V., Flores-Soto M.E., Merin Sigala M.E., et al. Proinflammatory cytokines, enolase and S-100 as early biochemical indicators of hypoxic-ischemic encephalopathy following perinatal asphyxia in newborns. Pediatr Neonatol. 2017; 58 (1): 70–6. https://doi.org/10.1016/j.pedneo.2016.05.001.
41. Fotopoulos S., Pavlou K., Skouteli H., et al. Early markers of brain damage in premature low-birth-weight neonates who suffered from perinatal asphyxia and/or infection. Biol Neonate. 2001; 79 (3–4): 213–8. https://doi.org/10.1159/000047094.
42. Hanin A., Denis J.A., Frazzini V., et al. Neuron specific enolase, S100beta protein and progranulin as diagnostic biomarkers of status epilepticus. J Neurol. 2022; 269 (7): 3752–60. https://doi.org/10.1007/s00415-022-11004-2.
43. Hanin A., Demeret S., Denis J.A., et al. Serum neuron-specific enolase: a new tool for seizure risk monitoring after status epilepticus. Eur J Neurol. 2022; 29 (3): 883–9. https://doi.org/10.1111/ene.15154.
44. Celtik C., Acunaş B., Oner N., Pala O. Neuron-specific enolase as a marker of the severity and outcome of hypoxic ischemic encephalopathy. Brain DEV. 2004; 26 (6): 398–402. https://doi.org/10.1016/j.braindev.2003.12.007.
45. Giuseppe D., Sergio C., Pasqua B., et al. Perinatal asphyxia in preterm neonates leads to serum changes in protein S-100 and neuron specific enolase. Curr NEUROVASC Res. 2009; 6 (2): 110–6. https://doi.org/10.2174/156720209788185614.
46. López-Suárez O., Concheiro-Guisán A., Sánchez-Pintos P., et al. Acylcarnitine profile in neonatal hypoxic-ischemic encephalopathy: the value of butyrylcarnitine as a prognostic marker. Medicine. 2019; 98 (15): e15221. https://doi.org/10.1097/MD.0000000000015221.
47. Nagdyman N., Kömen W., Ko H.K., et al. Early biochemical indicators of hypoxic-ischemic encephalopathy after birth asphyxia. Pediatr Res. 2001; 49 (4): 502–6. https://doi.org/10.1203/00006450-20010400000011.
48. Willoughby K.A., Kleindienst A., Müller C., et al. S100B protein is released by in vitro trauma and reduces delayed neuronal injury. J Neurochem. 2004; 91 (6): 1284–91. https://doi.org/10.1111/j.1471-4159.2004.02812.x.
49. Michetti F., Corvino V., Geloso M.C., et al. The S100B protein in biological fluids: more than a lifelong biomarker of brain distress. J Neurochem. 2012; 120 (5): 644–59. https://doi.org/10.1111/j.1471-4159.2011.07612.x.
50. Lam A.G., Koppal T., Akama K.T., et al. Mechanism of glial activation by S100B: involvement of the transcription factor NFkappaB. Neurobiol Aging. 2001; 22 (5): 765–72. https://doi.org/10.1016/s01974580(01)00233-0.
51. Gazzolo D., Marinoni E., Di Iorio R., et al. Measurement of urinary S100B protein concentrations for the early identification of brain damage in asphyxiated full-term infants. Arch Pediatr Adolesc Med. 2003; 157 (12): 1163–8. https://doi.org/10.1001/archpedi.157.12.1163.
52. Beharier O., Kahn J., Shusterman E., Sheiner E. S100B – a potential biomarker for early detection of neonatal brain damage following asphyxia. J Matern Fetal Neonatal Med. 2012; 25 (9): 1523–8. https://doi.org/10.3109/14767058.2012.664200.
53. Aisa M.C., Cappuccini B., Favilli A., et al. Biochemical and anthropometric parameters for the early recognition of the intrauterine growth restriction and preterm neonates at risk of impaired neurodevelopment. Int J Mol Sci. 2023; 24 (14): 11549. https://doi.org/10.3390/ijms241411549.
54. Gazzolo D., Bruschettini M., Lituania M., et al. Increased urinary S100B protein as an early indicator of intraventricular hemorrhage in preterm infants: correlation with the grade of hemorrhage. Clin Chem. 2001; 47 (10): 1836–8.
55. Tskitishvili E., Komoto Y., Temma-Asano K., et al. S100B protein expression in the amnion and amniotic fluid in pregnancies complicated by pre-eclampsia. Mol Hum Reprod. 2006; 12 (12): 755–61. https://doi.org/10.1093/molehr/gal083.
56. Gazzolo D., Marinoni E., Di Iorio R., et al. High maternal blood S100B concentrations in pregnancies complicated by intrauterine growth restriction and intraventricular hemorrhage. Clin Chem. 2006; 52 (5): 819–26. https://doi.org/10.1373/clinchem.2005.060665.
57. Milne G.L., Musiek E.S., Morrow J.D. F2-isoprostanes as markers of oxidative stress in vivo: an overview. Biomarkers. 2005; 10 (Suppl. 1): S10–23. https://doi.org/10.1080/13547500500216546.
58. Matthews M.A., Aschner J.L., Stark A.R., et al. Increasing F2-isoprostanes in the first month after birth predicts poor respiratory and neurodevelopmental outcomes in very preterm infants. J Perinatol. 2016; 36 (9): 779–83. https://doi.org/10.1038/jp.2016.74.
59. Coviello C., Perrone S., Buonocore G., et al. Oxidative stress biomarkers and early brain activity in extremely preterm infants: a prospective cohort study. Children. 2022; 9 (9): 1376. https://doi.org/10.3390/children9091376.
60. Coviello C., Tataranno M.L., Corsini I., et al. Isoprostanes as biomarker for patent ductus arteriosus in preterm infants. Front Pediatr. 2020; 8: 555. https://doi.org/10.3389/fped.2020.00555.
61. Green D.W., Hendon B., Mimouni F.B. Nucleated erythrocytes and intraventricular hemorrhage in preterm neonates. Pediatrics. 1995; 96 (3 Pt 1): 475–8.
62. Florio P., Perrone S., Luisi S., et al. Activin a plasma levels at birth: an index of fetal hypoxia in preterm newborn. Pediatr Res. 2003; 54 (5): 696–700. https://doi.org/10.1203/01.PDR.0000086905.71963.1D.
Об авторах
А. Г. АлександровРоссия
Александров Андрей Георгиевич - к.б.н. Scopus Author ID: 57211350219.
Ул. Садовая-Триумфальная, д. 4/10, Москва 127006; ул. Быкова, д. 84Б, Ленинградская обл., Всеволожский р-н, Колтушское с/п, с. Павлово 188680
Д. А. Петренко
Россия
Петренко Дарья Андреевна
Ул. Трубецкая, д. 8/2, Москва 119048
Рецензия
Для цитирования:
Александров А.Г., Петренко Д.А. Перспективные биомаркеры нарушения проницаемости гематоэнцефалического барьера в реабилитации детей с перинатальным гипоксическиишемическим поражением центральной нервной системы. Реабилитология. 2024;2(2):207-215. https://doi.org/10.17749/2949-5873/rehabil.2024.9
For citation:
Aleksandrov A.G., Petrenko D.A. Promising biomarkers of blood-brain barrier permeability impairment in rehabilitation of infants with perinatal hypoxic-ischemic central nervous system injury. Journal of Medical Rehabilitation. 2024;2(2):207-215. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.9






