Перейти к:
Коррекция гемостаза в лечении и реабилитации пациентов с COVID-19
https://doi.org/10.17749/2949-5873/rehabil.2023.3
Аннотация
Актуальность. Известно, что тяжелое течение новой коронавирусной инфекции (НКИ) нередко сопровождается существенным риском возникновения нарушений со стороны системы гемостаза. В отличие от других видов коагулопатий, вирус-ассоциированная коагулопатия при COVID-19, по всей видимости, напрямую связана с провоспалительными процессами и неадекватным ответом со стороны иммунной системы.
Цель: определить основные механизмы развития иммуноопосредованной коагулопатии у пациентов с НКИ и способы коррекции данного патологического состояния.
Материал и методы. Поиск исследований, посвященных изучению коагулопатии при COVID-19, лечению и реабилитации пациентов с данным осложнением проводили в международных научных базах данных PubMed/MEDLINE, Google Scholar, ScienceDirect и научной электронной библиотеке eLibrary. Глубина поиска составила 20 лет. Учитывали также результаты запросов в поисковых системах Яндекс и Google. После отбора публикаций, выполненного согласно рекомендациям PRISMA, в обзор включено 73 статьи.
Результаты. «Порочный патологический круг», связанный с цитокиновым штормом, лежит в основе патогенетических механизмов иммуноопосредованного тромбоза у пациентов с COVID-19. Немалая роль в развитии коагулопатии отводится эндотелиальной дисфункции, внеклеточным ловушкам нейтрофилов (англ. neutrophil extracellular traps, NETs), тромбоцитопатии и изменению активности системы комплемента. Терапия осложнения носит в первую очередь патогенетический характер. Показана эффективность антикоагулянтов, противовоспалительных препаратов, антиагрегантов, а также препаратов, направленных на ограничение роли NETs и системы комплемента в развитии тромбозов. Рассматривается целесообразность профилактического применения антикоагулянтов у пациентов с COVID-19. Представлена информация о реабилитации больных с коагулопатией при НКИ. Продемонстрирована эффективность комбинированной противовоспалительной и антикоагулянтной терапии при COVID-19 как компонента комплексной реабилитации.
Заключение. Процессы воспаления и иммунный ответ играют существенную роль в развитии коагулопатии у пациентов с НКИ. Совокупность всех патогенетических изменений со стороны иммунной системы, воспалительного ответа и системы гемостаза обусловливает сложность проведения терапевтических мероприятий. Общая схема реабилитации больных COVID-19 должна включать три этапа, также целесообразно своевременное применение комбинированной противовоспалительной и антикоагулянтной терапии.
Ключевые слова
Для цитирования:
Григорьева К.Н., Гашимова Н.Р., Цибизова В.И. Коррекция гемостаза в лечении и реабилитации пациентов с COVID-19. Реабилитология. 2023;1(1):49-59. https://doi.org/10.17749/2949-5873/rehabil.2023.3
For citation:
Grigoreva К.N., Gashimova N.R., Tsibizova V.I. Hemostasis correction in the treatment and rehabilitation of COVID-19 patients. Journal of Medical Rehabilitation. 2023;1(1):49-59. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2023.3
ВВЕДЕНИЕ / INTRODUCTION
Среднетяжелое и тяжелое течение новой коронавирусной инфекции (НКИ) сопровождается высоким риском тромбоэмболических осложнений, что связано с изменениями в системе гемостаза [1–3]. Согласно накопленному опыту у больных COVID-19 было зафиксировано значительное количество отклонений лабораторных показателей коагуляции, включая концентрацию D-димера, протромбиновое время, уровень фибриногена, концентрацию продуктов деградации фибриногена, количество тромбоцитов, уровень фактора свертывания VIII и концентрацию фактора фон Виллебранда (фВ) в плазме крови. Нарушение системы гемостаза сопровождается развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС) [3][4].
На ранней фазе заболевания наблюдается «адаптированная» активация свертывания крови в ответ на индуцированное вирусом воспаление: умеренное повышение уровня D-димера, концентрации продуктов деградации фибриногена, уровня фибриногена и развитие тромбоцитоза. По мере прогрессирования заболевания удлинение протромбинового времени, дальнейшее увеличение уровня D-димера и тромбоцитопения являются прогностически неблагоприятными признаками и ассоциируются с высокой смертностью [2][3].
Недавние исследования показали, что частота венозной тромбоэмболии (ВТЭ) и тромбоэмболии легочной артерии у госпитализированных пациентов с НКИ составляет 17% и 7,1% соответственно, тогда как распространенность крупных кровотечений – всего 3,9% [5–7]. Следует отметить, что у больных COVID-19, попавших в отделение реанимации и интенсивной терапии, наблюдается более высокий показатель частоты ВТЭ – 28% [8].
Коагулопатия в рамках НКИ является уникальной: она характеризуется образованием тромбов с повышенным уровнем цитокинов, включая фактор некроза опухоли альфа (ФНО-α), интерлейкины (ИЛ) 6, 8 и др. [8][9]. Провоспалительные белки и иммунные клетки считаются основными факторами развития тромбоза у пациентов с COVID-19. Временное повышение риска тромбообразования, вызванное вирусами (включая SARS-CoV-2), указывает на то, что последующий иммунный ответ носителя заболевания представляет собой основной триггер сосудистых тромбоэмболических событий [3][9][10].
Роль воспаления в патогенезе тромбообразования при НКИ остается не до конца изученной. Так, показана невозможность полностью предотвратить гиперкоагуляцию с помощью только антитромботических препаратов у пациентов с COVID-19. Приведенные выше данные свидетельствуют в пользу гипотезы об иммунотромбозе как о ведущем патогенетическом звене тяжелого течения НКИ [8–11].
Таким образом, своевременная антитромботическая профилактика, патогенетическая терапия, направленная на механизмы иммунотромбоза, могут составить основы лечения и реабилитации пациентов с COVID-19, в особенности при тяжелом течении заболевания.
Цель – определить основные механизмы развития иммуноопосредованной коагулопатии у пациентов с НКИ и способы коррекции данного патологического состояния.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Поиск публикаций проведен в научных базах данных PubMed/MEDLINE, Google Scholar, ScienceDirect и электронной библиотеке eLibrary. Глубина поиска составила 20 лет. Также в обзор включены результаты запросов в поисковых системах Google и Яндекс. Для анализа выбраны публикации на русском и английском языках.
На первом этапе вели поиск публикаций с помощью запросов: «коронавирусная инфекция», «COVID-19», «гемостаз», «коагулопатия», «механизм», “coronavirus disease”, “COVID-19”, “hemostasis’, “coagulopathy”, “mechanism”. Далее из полученной выборки отбирали исследования, включающие слова: «иммунитет», «лечение», «реабилитация», “immunity”, “treatment”, “rehabilitation”. На следующем этапе исключали дублирующие публикации. Затем выполняли поиск полнотекстовых версий исследований. На последнем этапе публикации проверяли на авторитетность источника (рецензируемые журналы, официальные сайты) и соответствие полнотекстовой версии документа тематике обзора.
Спорные ситуации, связанные с включением публикации в обзор, разрешали коллегиально путем голосования.
Отбор исследований / Selection of publications
Выявлено 2958 публикаций, посвященных состоянию системы гемостаза при НКИ. Из них отобраны статьи, посвященные участию иммунной системы в данном процессе, а также терапии и реабилитации пациентов с COVID-19. После этого осталось 230 статей, из которых 18 дублировали результаты, что связано с поиском публикаций в разных источниках. Из оставшихся исследований только для 175 работ найдены полные тексты.
После подробного ознакомления с полными текстами статей и источниками, из которых были получены публикации, полностью соответствовали тематике обзора только 73 работы.
Схема отбора публикаций представлена на рисунке 1.
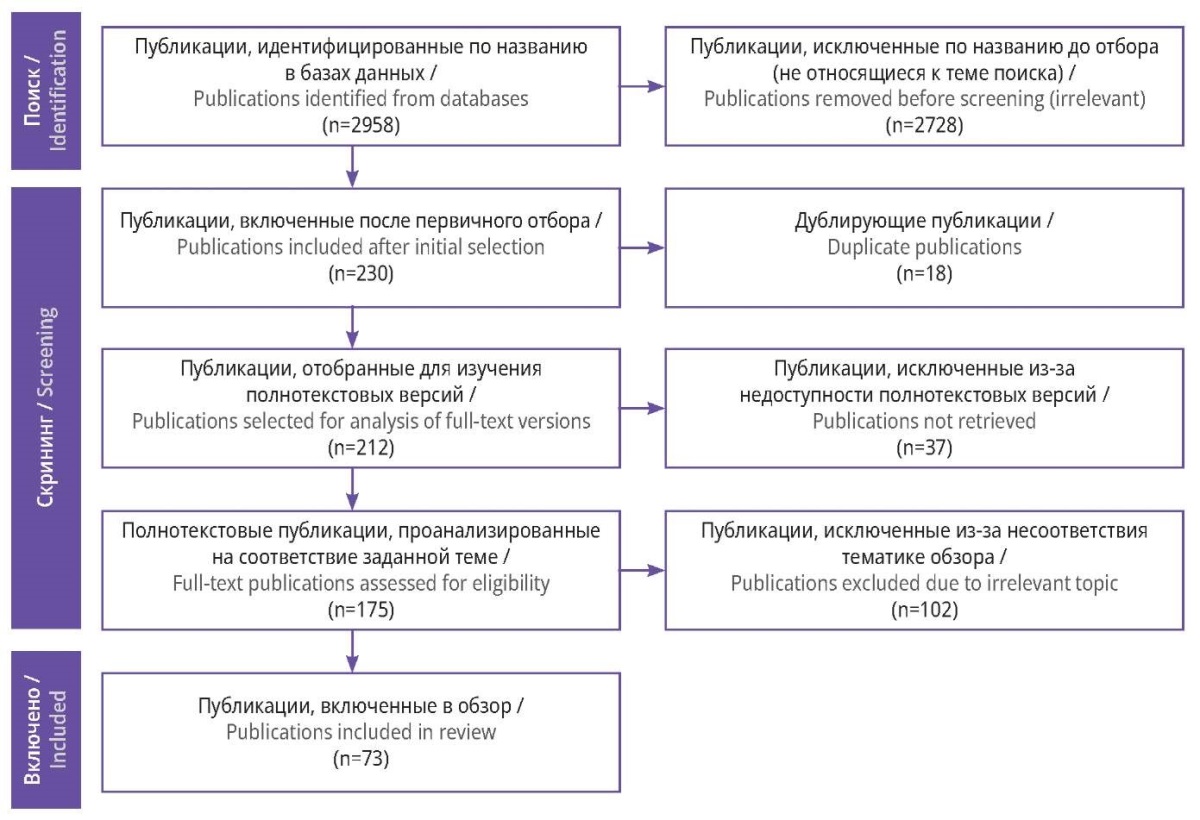
Рисунок 1. Блок-схема отбора публикаций с учетом рекомендаций PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses)
workflow for selection of publications
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Патогенетические механизмы иммунного тромбоза / Pathogenetic mechanisms of immune thrombosis
Формирование «патологического порочного круга»
Тяжелая форма COVID-19 является результатом прогрессирующего повреждения тканей и органов, вызванного репликацией SARS-CoV-2 и ответной реакцией носителя инфекции [12]. Белок-шип (S) в вирусной оболочке существует в виде гомотримеров, включая субъединицу S1, связывающую рецептор, и субъединицу S2, слитую с мембраной. Рецептор-связывающий домен субъединицы S1 вируса соединяется с ангиотензинпревращающим ферментом-2 на эпителии носоглотки. После слияния мембран вируса и хозяина следует репликация вирусной РНК, сборка и высвобождение вирусных частиц [13–15].
РНК SARS-CoV-2 распознается клетками врожденного иммунитета через толл-подобные рецепторы (англ. toll-like receptor, TLR), включая TLR3, TLR7, TLR8, а также NOD-подобные рецепторы (англ. nucleotide-binding oligomerization domain-like receptor, NLR). Затем через каскад сигнальных путей активированный транскрипционный ядерный фактор каппа В (англ. nuclear factor kappa B, NF-κB) индуцирует выработку провоспалительных цитокинов, способствующих формированию цитокинового шторма. Кроме того, сообщалось, что SARS-CoV-2 усугубляет воспалительную реакцию миелоидных клеток через рецепторы лектина C-типа (англ. C-type lectin, CLEC) [16].
К семейству лектинов С-типа также относятся: специфичный для дендритных клеток ICAM-31-захватывающий неинтегрин (англ. dendritic ICAM-3-grabbing non-integrin, DC-SIGN), специфичный для печени и лимфатических узлов ICAM-3-захватывающий неинтегрин (англ. liver/lymph node-specific ICAM-3-grabbing non-integrin, L-SIGN), лектины CLEC5A и CLEC2. Указанные белки имеют решающее значение для индуцированного вирусом образования внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs) [17]. Следовательно, блокада лектинов C-типа является многообещающей стратегией для ослабления индуцированного вирусом образования NETs. Исследования показывают, что экстрацеллюлярные везикулы, высвобождаемые из тромбоцитов, активированных SARS-CoV-2, вызывают устойчивое образование NETs посредством CLEC5A и TLR2, что, в свою очередь, усиливает тромбоз [18].
Регуляторный фактор интерферона 3/7 (англ. interferon regulatory factor 3/7, IRF3/7) усиливает транскрипцию интерферона, запуская противовирусный ответ хозяина. Все больше данных указывает на значительное снижение защитных реакций IRF1 у пациентов с COVID-19, что приводит к прогрессированию заболевания [12].
В паренхиме легких вирус повреждает альвеолярные эпителиальные клетки, высвобождая молекулярные фрагменты, ассоциированные с опасностью (англ. danger-associated molecular patterns, DAMPs), включая нуклеосомы, гистоны и белок группы высокой подвижности В1 (англ. high-mobility group protein B1, HMGB1) человека [19]. Остатки разрушенных клеток существенно усиливают продукцию хемокинов и цитокинов, таких как ФНО-α, ИЛ-6, ИЛ-1β, в локально расположенных клетках, участвующих во врожденном иммунном ответе. Указанные цитокины и хемокины выступают в роли аттрактантов и привлекают все больше клеток врожденного иммунитета (нейтрофилы, моноциты, макрофаги, естественные клетки-киллеры (англ. natural killer-cells, NK-cells), усиливают синтез цитокинов адаптивными иммунными клетками (CD4+, CD8+T). DAMPs и цитокины индуцируют повышенное высвобождение фВ из телец Вейбеля–Паладе на поверхности эндотелиальных клеток (ЭК). Тромбоциты связываются с фВ на ЭК через гликопротеин Ib (англ. glycoprotein Ib, GPIb). Металлопротеиназа ADAMTS13 (англ. A disintegrin and metalloprotease with thrombospondin 1 repeats, number 13) регулирует размер мультимеров фВ и ингибирует тромбоз путем расщепления фВ [20][21]. Повышенный уровень фВ и снижение содержания ADAMTS13 являются мощными предикторами неблагоприятных исходов у пациентов с тяжелым течением COVID-19 [22]. Таким образом, изменения в ЭК, повышенное высвобождение фВ и его относительно недостаточное расщепление в условиях дефицита ADAMTS13 являются пусковым звеном усиления взаимодействия между тромбоцитами и стенкой сосуда, вызывая тромботические микроангиопатии.
Такой каскад в итоге приводит к цитокиновому шторму [23][24]. Накопление провоспалительных молекул усугубляет патологические изменения в альвеолярном эпителии, вплоть до отслаивания и некроза. Данные изменения способствуют выбросу DAPMs, тем самым замыкая петлю положительной обратной связи повреждения альвеолярных эпителиоцитов и образуя «порочный патологический круг». Таким образом, клетки, участвующие в формировании иммунного ответа, в частности миелоидные клетки, являются основным источником воспалительной дисрегуляции в легочной ткани пациентов с COVID-19, что было подтверждено в клиническом исследовании [25].
Маркеры воспаления у пациентов при COVID-19
Показана значительная роль провоспалительных цитокинов в течении инфекционного процесса и иммунного ответа у больных COVID-19. В плазме пациентов наблюдаются повышенные уровни ИЛ-6, ИЛ-8, моноцитарного хемоаттрактантного белка-1 (англ. monocyte chemotactic protein 1, МСР-1), С-реактивного белка (СРБ) и ФНО-α. Отмечают существенную прямую корреляцию между концентрацией ИЛ-6, ФНО-α и СРБ в сыворотке крови с тяжестью течения заболевания [26][27].
Эндотелиальная дисфункция
ЭК поддерживают нормальную вязкость крови, целостность сосудистой стенки, выполняют барьерную функцию (благодаря межклеточным плотным контактам и адгезии), а также контролируют «сосудистый» гомеостаз за счет противовоспалительного и антикоагулянтного действия. Находящийся на эндотелии ангиотензинпревращающий фермент-2 участвует в модификации ангиотензина, который связывается с рецептором Mas1, модулируя противовоспалительные и антитромботические сигнальные пути [28].
Кроме того, в мембранах ЭК находятся интегральный белок тромбомодулин, связывающий тромбин и играющий роль антикоагулянтного кофактора, рецептор эндотелиального протеина С (англ. endothelial protein C receptor, EPCR) и ингибитор пути тканевого фактора (англ. tissue factor pathway inhibitor, TFPI), блокирующий фактор свертывания Х (антикоагулянтное действие через внешний путь коагуляции) [3][29]. ЭК могут секретировать тканевой и урокиназный активаторы плазминогена (англ. tissue plasminogen activator, t-PA; urokinase plasminogen activator, u-PA), экспрессировать рецептор u-PA, обеспечивая мощный фибринолитический механизм. Защиту эндотелия от системы комплемента обеспечивают специфические ингибиторы. Предотвращать адгезию тромбоцитов ЭК могут за счет экспрессии CD39, высвобождения простагландина I2 (англ. prostaglandin I2, PGI2) и оксида азота. Эти молекулы обладают цитопротекторными свойствами: оксид азота может подавлять рекрутирование лейкоцитов на стенку сосуда, а PGI2 – снижать адгезию, активацию и экстравазацию лейкоцитов, ослабляя воспалительные реакции [29][30].
В условиях повреждения эндотелия нарушаются его антикоагулянтные, фибринолитические, цитопротекторные, регуляторные свойства. Повреждение эндотелия сосудов – составляющий фактор триады Вирхова, причем это первый и критический этап формирования тромбоза. Является ли эндотелиальная дисфункция в первую очередь результатом прямого инфицирования эндотелиальных клеток SARS-CoV-2, еще предстоит определить, но биомаркеры эндотелиальной дисфункции, такие как тромбомодулин, фВ, ангиопоэтин-2 и ингибитор активатора плазминогена 1 (plasminogen activator inhibitor 1, PAI-1), как было показано, повышены у пациентов с COVID-19 по сравнению с группами контроля и, по-видимому, имеют прогностическое значение, поскольку связаны с тяжелым течением заболевания [31].
Внеклеточные ловушки нейтрофилов
Активированные тромбоциты высвобождают внеклеточные везикулы с HMGB1, побуждая нейтрофилы создавать NETs, паутинные структуры которых захватывают клетки крови и факторы свертывания [32]. В свою очередь, антимикробные пептиды, продуцируемые NETs, могут привести к образованию сшивок между тромбоцитами и компонентами нейтрофильной ловушки, что вызывает иммунотромбообразование. Взаимодействие тромбоцитов с иммунными клетками в рамках NETs стимулирует систему свертывания крови и тем самым соединяет коагуляционные биохимические каскады и воспалительные сигнальные пути [33].
NETs могут связываться с тканевыми факторами, способствуя образованию фибрина. Эктопированная внутриклеточная ДНК, составляющая NETs, обеспечивает отрицательно заряженную поверхность, позволяющую захватывать фактор Хагемана (FXII) и активировать контактный (внутренний) путь коагуляции, что проявляется в виде окклюзии микрососудов [34][35]. Кроме того, нейтрофильная эластаза и миелопероксидаза вызывают прокоагулянтный сдвиг гемостатического баланса и локальное образование тромбов. Так, нейтрофильная эластаза участвует в расщеплении ингибитора тканевого фактора, функционирующего в регуляции системы свертывания, а миелопероксидаза действует в данном процессе неспецифическим образом, увеличивая концентрацию активных форм кислорода [36].
По данным проспективного когортного исследования, у 10 из 21 пациента с COVID-19 при проведении аутопсии отмечена нейтрофильная эмболия [37]. Гистологические исследования легких и других органов подтверждали роль NETs в микрососудистой обструкции [27].
Система комплемента
Вирус SARS-CoV-2 активирует каскад комплемента классическим и лектиновым путями. Система комплемента вносит основной вклад в воспаление и тромбоз: C3a и C5a привлекают и активируют нейтрофилы и моноциты для высвобождения провоспалительных цитокинов (ИЛ-6, ИЛ-8), C5a повышает экспрессию тканевого фактора на нейтрофилах и ЭК, что, в свою очередь, оказывает прокоагулянтный эффект, а C5a также может ингибировать фибринолиз за счет повышенного высвобождения PAI-1 из тучных клеток и базофилов [38][39].
В эксперименте in vitro показана способность плазмы крови пациентов с COVID-19 индуцировать активацию комплемента, вызывающую образование NETs C5a-зависимым образом [40]. Мембраноатакующий комплекс (MAC) побуждает ЭК активно секретировать фВ и формировать протромбиназный комплекс [41]. Множественные комплементцентрические взаимосвязи между путями воспаления и протромботическими механизмами действуют синергически, подавляя патогены. Факторы комплемента (C1q и C3) и MAC могут активировать тромбоциты, что проявляется увеличением их адгезии и агрегации и приводит к усилению провоспалительного ответа нейтрофилов за счет связывания с комплементом [42][43].
Более того, тромбоциты захватывают патогены C3- и GPIbα-зависимым способом, транспортируют их к антигенпрезентирующим дендритным клеткам и тем самым инициируют адаптивные иммунные реакции [44]. Факторы комплемента (C5b-9 и C4b) и протеаза MASP2 (англ. mannan-binding lectin serine protease 2) обнаружены в микрососудах легких у пациентов с тяжелым течением COVID-19 [45][46]. Согласно результатам аутопсии активация системы комплемента связана с окклюзией сосудов микроциркуляторного русла при тяжелом течении НКИ.
Тромбоцитопатия
Тромбоциты у больных COVID-19 характеризуются гиперреактивностью, что проявляется повышенной агрегацией, увеличением концентрации CD40 и Р-селектина. В ретроспективном исследовании с участием 300 пациентов с НКИ высокий уровень Р-селектина в плазме крови при поступлении был ассоциирован с последующей постановкой диагноза ВТЭ [47].
Согласно результатам метаанализа 15 исследований наличие более крупных и незрелых тромбоцитов у больных связано с повышенным риском тромбоза и смерти [48]. Кроме того, анализы тканей и крови пациентов с COVID-19 показали, что вирионы SARS-CoV-2 проникают в мегакариоциты и тромбоциты, индуцируют изменения в транскриптоме тромбоцитов и изменяют профиль активации данных клеток [49].
Лечение и реабилитация пациентов с COVID-19 / Treatment and rehabilitation of COVID-19 patients
Вышеприведенные данные подтверждают существенную роль иммунитета в нарушении работы системы гемостаза у больных COVID-19. Представленная совокупность всех патогенетических изменений со стороны иммунной системы, воспалительного ответа и системы гемостаза у пациентов данного профиля обусловливает сложность проведения терапевтических мероприятий. Тактика ведения пациентов с НКИ требует мультидисциплинарного комплексного подхода и предполагает длительные реабилитационные мероприятия, т.к. после основного этапа лечения и элиминации самого вируса остаются различные постинфекционные осложнения, коррекция которых является целью проведения реабилитации.
Фармакотерапия
Согласно клиническим рекомендациям по лечению COVID-19 этиотропная терапия включает следующие препараты: фавипиравир, молнупиравир, нирматрелвир + ритонавир, ремдесивир, синтетическая малая интерферирующая двуцепочечная рибонуклеиновая кислота, препараты моноклональных антител, умифеновир и интерферон-альфа. Противовирусное лечение должно быть начато как можно раньше для профилактики иммунотромбообразования и других иммуноопосредованных осложнений [50].
Патогенетическая терапия, направленная на коррекцию самоподдерживающихся патогенетических процессов (ДВС-синдром, иммунотромбоз), включает антикоагулянтную, антиагрегантную, противовоспалительную и экспериментальную таргетную терапию. Исследования показывают неоднозначную эффективность применяемой профилактической антикоагулянтной терапии у пациентов с COVID-19. Однако большинство авторов склоняются к эффективности данной профилактики, указывая на снижение частоты тромбозов и улучшение прогноза исхода заболевания [51–53]. При этом отмечают эффективность профилактических терапевтических доз антикоагулянтов в снижении риска тромбоэмболических осложнений и необходимость проведения кардиотонической и респираторной поддержки. В проспективном исследовании с участием 803 госпитализированных пациентов с НКИ увеличение доз антикоагулянтов, определяемое сочетанием тяжести заболевания, массы тела и уровня D-димера, было связано со снижением смертности [54].
Эффективность антикоагулянтной терапии зависит от времени ее начала. По мере прогрессирования заболевания терапевтический эффект антикоагулянтов может быть неудовлетворительным из-за формирования общего звена воспаления с каскадами свертывания крови. Кроме того, тромбоз в рамках ДВС-синдрома приводит к ожидаемому снижению прокоагуляционных факторов, а терапия антикоагулянтами в полной дозе, наоборот, увеличивает риск кровотечения [54][55].
Таким образом, раннее назначение антикоагулянтов в терапевтических дозах может эффективно снизить частоту тромбозов. Профилактическая антикоагулянтная терапия пациентов с COVID-19 после выписки остается спорной, однако может быть полезна больным с высоким риском ВТЭ. Так, у пациентов с высоким риском ВТЭ, выписанных после госпитализации по поводу COVID-19, тромбопрофилактика ривароксабаном в дозе 10 мг/день в течение 35 дней улучшала клинические результаты по сравнению с непродленной тромбопрофилактикой [56].
Тромботические явления считаются основной причиной смертности от COVID-19, и по действующим рекомендациям предлагается использовать гепарин для тромбопрофилактики и антикоагулянтной терапии [57]. Нефракционированный гепарин и низкомолекулярный гепарин (НМГ) могут связываться с антитромбином и усиливать его ингибирующее действие на фактор Xa и тромбин [58][59]. Накопленные данные свидетельствуют о том, что гепарин также ограничивает развитие провоспалительного ответа, в частности путем ингибирования как селектин-индуцированной адгезии нейтрофилов, так и высвобождения медиаторов воспаления [60][61].
Многообещающие результаты также были получены при использовании ингибиторов фактора Xa (в первую очередь апиксабана) в предотвращении тромботических осложнений и снижении риска кровотечений у пациентов с COVID-19 по сравнению с НМГ [62].
Учитывая небольшое количество побочных эффектов фибринолитической терапии, раннее и местное применение t-PA в сочетании с противовоспалительной терапией, направленной на цитокины и хемокины, может улучшить выживаемость у тяжелых пациентов с НКИ и острым респираторным дистресс-синдромом (ОРДС) [63][64]. Для больных COVID-19 без ОРДС или других тяжелых осложнений фибринолитическая терапия может значительно улучшить прогноз исхода заболевания. В настоящее время отчеты о клинических случаях и сериях случаев показывают, что t-PA обладает значительной эффективностью у пациентов с развившимся ОРДС на фоне COVID-19, что проявлялось улучшением индекса оксигенации PaO2/FiO2 и отсутствием геморрагических нежелательных явлений [65].
При COVID-19 FXII является привлекательной и рациональной терапевтической мишенью. FXII может индуцировать активацию брадикинина, а затем комплемента и продукцию воспалительных цитокинов [66]. Ингибиторы FXII, человеческие или гуманизированные моноклональные антитела (включая 3F7) блокируют NETs-опосредованный внутренний путь коагуляции и оказывают противовоспалительное действие [67].
В качестве антиагрегантной терапии можно использовать три класса препаратов. К первому относится аспирин, который необратимо инактивирует циклооксигеназу-1 тромбоцитов, тем самым эффективно предотвращая выработку агониста тромбоцитов тромбоксана А2. Второй класс препаратов, подавляющих активацию тромбоцитов, – антагонисты рецепторов P2Y12 (клопидогрел). И к третьему классу относится одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. U.S. Food and Drug Administration, FDA) антагонист PAR1 (ворапаксар) [68][69].
Также показано, что помимо антитромботической активности, обусловленной ингибированием агрегации тромбоцитов, дипиридамол обладает противовирусными, противовоспалительными и антиоксидантными свойствами. В настоящее время проводятся клинические испытания по оценке эффектов дипиридамола у пациентов с COVID-19 [70][71].
Учитывая роль воспаления в тромбогенезе при НКИ, использование лишь одной антикоагулянтной терапии не сможет исключить риск развития тромбоза. Поэтому у пациентов данного профиля необходимо рассматривать комбинированную противовоспалительную и антикоагулянтную терапию в качестве предпочтительной опции [67–74]. Анакинра − рекомбинантный антагонист рецепторов человеческого ИЛ-1. В исследовании с участием 600 пациентов с пневмонией на фоне COVID-19 и с риском развития дыхательной недостаточности анакинра значительно улучшила выживаемость и сократила продолжительность госпитализации [74].
Недавние метаанализы продемонстрировали, что лечение анакинрой приносит наибольшую пользу пациентам с COVID-19, у которых концентрация СРБ в сыворотке превышает 100 мг/л [75][76]. В других исследованиях оценка уровня растворимого рецептора u-PA позволила прогнозировать риск тяжелого течения COVID-19 на ранних стадиях. Обнаружено, что анакинра существенно снижает прогрессирование тяжелой дыхательной недостаточности и улучшает прогноз 30-дневной выживаемости пациентов [77].
Тоцилизумаб, гуманизированное моноклональное антитело, направленное на рецепторы ИЛ-6, представляет собой иммунодепрессант, используемый при лечении хронического ревматоидного артрита. У госпитализированных больных COVID-19 лечение антагонистом рецептора ИЛ-6 снизило общую смертность, особенно у пациентов на неинвазивной и инвазивной механической респираторной поддержке [78].
Анти-ФНО-α-терапия ассоциирована с более низким уровнем госпитализации и снижением числа случаев тяжелого течения COVID-19 (поступление в отделения интенсивной терапии или смерть) [79]. Однако эти медиаторы воспаления играют решающую роль в иммунной защите организма-хозяина. Следовательно, при выборе таргетной терапии необходимо взвешивать риски, учитывая потенциальные преимущества подавления цитокинового шторма и вероятность снижения защитно-адаптационных резервов от патогенов.
Компоненты NETs считаются потенциальными мишенями для терапии пациентов с COVID-19. Наиболее известными таргетными препаратами, направленными на подавление образования NETs, является Cl-амидин, ингибитор протеин-аргининдеиминазы-4, и ингибитор нейтрофильной эластазы сивелестат (ONO-5046) [72]. Показано, что Cl-амидин ингибирует высвобождение NETs из нейтрофилов крови пациентов с COVID-19 [73]. Сивелестат может улучшить функцию легких и насыщение кислородом у больных с ОРДС. Новое поколение ингибиторов нейтрофильной эластазы проходит клинические испытания [80].
Также интересной представляется стратегия «антикомплементарной» терапии. В плазме крови пациентов с НКИ наблюдаются повышенные уровни нескольких факторов комплемента (C3 и C5), и это коррелирует с тяжестью заболевания [3][16–18][20–25]. В нерандомизированном клиническом исследовании экулизумаб (ингибитор C5) значительно улучшил 15-дневную выживаемость и оксигенацию у пациентов с тяжелым течением COVID-19 [81]. Ингибитор C3 AMY-101 использовался у данной категории больных и в настоящее время проходит оценку в нескольких клинических испытаниях. Нарсоплимаб (антитело против MASP2), ингибирующий лектиновый путь, показал эффективность в небольшом исследовании пациентов с НКИ [82].
Реабилитация
Согласно клиническим рекомендациям пациентам с коронавирусной пневмонией, находящимся в отделениях интенсивной терапии, следует начать медицинскую реабилитацию, как только их состояние стабилизируется. Восстановительные мероприятия необходимо продолжать и после выписки в домашних условиях. Процесс реабилитации должен быть организован в медицинских учреждениях с тремя различными уровнями оказания медицинской помощи с учетом специфических потребностей больных на разных этапах их выздоровления [83].
На первом этапе пациентам важно получать специализированную помощь от многопрофильной реабилитационной бригады в отделениях интенсивной терапии и инфекционных/терапевтических отделениях. Эта команда должна быть обучена оказанию помощи больным с такими задачами, как отлучение от аппарата искусственной вентиляции легких, респираторная реабилитация, поддержка питания, восстановление толерантности к физической нагрузке и лечение любого возникшего синдрома после интенсивной терапии.
Второй этап медицинской реабилитации должен осуществляться в отделениях, специально предназначенных для пациентов с соматическими заболеваниями.
Третий этап реабилитации может проходить в дневных стационарах, амбулаторных отделениях или на дому с использованием телемедицинских технологий. Больные могут быть направлены на эти этапы медицинской комиссией из организации, которая оказывала помощь на первом или втором этапах, или из поликлиники, которая занимается их текущим лечением. Пациентам, которые прошли полный курс реабилитации более года назад, рекомендуется пройти повторный курс.
С учетом имеющихся литературных данных о ДВС-синдроме в рамках иммунотромбоза как ключевого патогенетического звена НКИ тяжелого течения представляется целесообразным своевременное применение комбинированной противовоспалительной и антикоагулянтной терапии как компонента комплексной реабилитации. На этапе амбулаторных восстановительных мероприятий после выписки из стационара возможно назначение антикоагулянтной терапии пациентам с высоким риском ВТЭ, а также выполнение специального комплекса лечебной физической культуры в качестве профилактики тромбоэмболических осложнений.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Одним из основных патогенетических паттернов COVID-19 является иммуноопосредованный тромбоз. Воспаление запускает биохимические каскады свертывания крови и образует положительную обратную связь в воспалительно-коагуляционном пути, что оказывает повреждающее действие на альвеолярный эпителий и эндотелий сосудов, преимущественно микроциркуляторного русла. Все это способствует тяжелому течению НКИ, причем иммуновоспалительные маркеры и факторы гемостаза позволяют прогнозировать исход заболевания.
Патогенетическая терапия предполагает комбинированное лечение, направленное на коррекцию иммунного и коагуляционного компонентов течения COVID-19 у пациентов. На текущий момент достаточно хорошо изучена эффективность антикоагулянтной терапии гепарином, НМГ и различными вариантами противовоспалительных препаратов в зависимости от профиля пациента.
Реабилитация больных COVID-19 подразумевает своевременное начало профилактики тромботических осложнений, применение таргетных лекарственных препаратов, которые воздействуют на главные патогенетические механизмы иммунного ДВС-синдрома, и проведение восстановительных мероприятий после выписки из стационара на дому с использованием телемедицинских технологий и выполнением комплекса специальных упражнений для дальнейшего снижения риска тромботических осложнений в отдаленном периоде.
1. ICAM-3 (англ. inter-cellular adhesion molecule 3) – молекула межклеточной адгезии 3.
Список литературы
1. Hvas C.L., Larsen J.B., Adelborg K., et al. Dynamic hemostasis and fibrinolysis assays in intensive care COVID-19 patients and association with thrombosis and bleeding – a systematic review and a cohort study. Semin Thromb Hemost. 2022; 48 (1): 31–54. https://doi.org/10.1055/s-0041-1735454.
2. Reis S., Popp M., Schießer S., et al. Anticoagulation in COVID-19 patients – an updated systematic review and meta-analysis. Thromb Res. 2022; 219: 40–8. https://doi.org/10.1016/j.thromres.2022.09.001.
3. Fei Y., Tang N., Liu H., Cao W. Coagulation dysfunction. Arch Pathol Lab Med. 2020; 144 (10): 1223–9. https://doi.org/10.5858/arpa.20200324-SA.
4. Jing H., Wu X., Xiang M., et al. Pathophysiological mechanisms of thrombosis in acute and long COVID-19. Front Immunol. 2022; 13: 992384. https://doi.org/10.3389/fimmu.2022.992384.
5. Farkouh M.E., Stone G.W., Lala A., et al. Anticoagulation in patients with COVID-19: JACC review topic of the week. J Am Coll Cardiol. 2022; 79 (9): 917–28. https://doi.org/10.1016/j.jacc.2021.12.023.
6. Jiménez D., García-Sanchez A., Rali P., et al. Incidence of VTE and bleeding among hospitalized patients with coronavirus disease 2019: a systematic review and meta-analysis. Chest. 2021; 159 (3): 1182–96. https://doi.org/10.1016/j.chest.2020.11.005.
7. Roncon L., Zuin M., Barco S., et al. Incidence of acute pulmonary embolism in COVID-19 patients: systematic review and meta-analysis. Eur J Intern Med. 2020; 82: 29–37. https://doi.org/10.1016/j.ejim.2020.09.006.
8. Mansory E.M., Srigunapalan S., Lazo-Langner A. Venous thromboembolism in hospitalized critical and noncritical COVID-19 patients: a systematic review and meta-analysis. TH Open. 2021; 5 (3): e286–94. https://doi.org/10.1055/s-0041-1730967.
9. Pitt B., Tate A.M., Gluck D., et al. Repurposing low-dose naltrexone for the prevention and treatment of immunothrombosis in COVID-19. Eur Heart J CARDIOVASC Pharmacother. 2022; 8 (4): 402–5. https://doi.org/10.1093/ehjcvp/pvac014.
10. Wienkamp A.K., Erpenbeck L., Rossaint J. Platelets in the NETworks interweaving inflammation and thrombosis. Front Immunol. 2022; 13: 953129. https://doi.org/10.3389/fimmu.2022.953129.
11. Corrales-Medina V.F., Musher D.M., Wells G.A., et al. Cardiac complications in patients with community-acquired pneumonia. Circulation. 2012; 125 (6): 773–81. https://doi.org/10.1161/CIRCULATIONAHA.111.040766.
12. Lowery S.A., Sariol A., Perlman S. Innate immune and inflammatory responses to SARS-CoV-2: implications for COVID-19. Cell Host Microbe. 2021; 29 (7): 1052–62. https://doi.org/10.1016/j.chom.2021.05.004.
13. Nagaraja S., Jain D., Kesavardhana S. Inflammasome regulation in driving COVID-19 severity in humans and immune tolerance in bats. J Leukoc Biol. 2022; 111 (2): 497–508. https://doi.org/10.1002/jLB.4COVHR0221-093RR.
14. Zhou Y.W., Xie Y., Tang L.S., et al. Therapeutic targets and interventional strategies in COVID-19: mechanisms and clinical studies. Signal Transduct Target Ther. 2021; 6 (1): 317. https://doi.org/10.1038/s41392-021-00733-x.
15. Islamuddin M., Mustfa S.A., Ullah S.N.M.N., et al. Innate immune response and inflammasome activation during SARS-CoV-2 infection. Inflammation. 2022; 45 (5): 1849–63. https://doi.org/10.1007/s10753022-01651-y.
16. Lu Q., Liu J., Zhao S., et al. SARS-CoV-2 exacerbates proinflammatory responses in myeloid cells through C-type lectin receptors and Tweety family member 2. Immunity. 2021; 54 (6): 1304–19.e9. https://doi.org/10.1016/j.immuni.2021.05.006.
17. Sung P.S., Hsieh S.L. C-type lectins and extracellular vesicles in virusinduced NETosis. J Biomed Sci. 2021; 28 (1): 46. https://doi.org/10.1186/s12929-021-00741-7.
18. Sung P.S., Yang S.P., Peng Y.C., et al. CLEC5A and TLR2 are critical in SARS-CoV-2-induced NET formation and lung inflammation. J Biomed Sci. 2022; 29 (1): 52. https://doi.org/10.1186/s12929-022-00832-z.
19. Parthasarathy U., Martinelli R., Vollmann E.H., et al. The impact of DAMP-mediated inflammation in severe COVID-19 and related disorders. Biochem Pharmacol. 2022; 195: 114847. https://doi.org/10.1016/j.bcp.2021.114847.
20. Mancini I., Baronciani L., Artoni A., et al. The ADAMTS13-von Willebrand factor axis in COVID-19 patients. J Thromb Haemost. 2021; 19 (2): 513–21. https://doi.org/10.1111/jth.15191.
21. Martinelli N., Montagnana M., Pizzolo F., et al. A relative ADAMTS13 deficiency supports the presence of a secondary microangiopathy in COVID 19. Thromb Res. 2020; 193: 170. https://doi.org/10.1016/j.thromres.2020.07.034.
22. Favaloro E.J., Henry B.M., Lippi G. Increased VWF and decreased ADAMTS-13 in COVID-19: creating a milieu for (micro)thrombosis. Semin Thromb Hemost. 2021; 47 (4): 400–18. https://doi.org/10.1055/s-0041-1727282.
23. Wielgat P., Narejko K., Car H. SARS-CoV-2 attacks in the brain: focus on the sialome. Cells. 2022; 11 (9): 1458. https://doi.org/10.3390/cells11091458.
24. Tang Y., Liu J., Zhang D., et al. Cytokine storm in COVID-19: the current evidence and treatment strategies. Front Immunol. 2020; 11: 1708. https://doi.org/10.3389/fimmu.2020.01708.
25. Melms J.C., Biermann J., Huang H., et al. A molecular single-cell lung atlas of lethal COVID-19. Nature. 2021; 595 (7865): 114–9. https://doi.org/10.1038/s41586-021-03569-1.
26. Smilowitz N.R., Kunichoff D., Garshick M., et al. C-reactive protein and clinical outcomes in patients with COVID-19. Eur Heart J. 2021; 42 (23): 2270–9. https://doi.org/10.1093/eurheartj/ehaa1103.
27. Gorog D.A., Storey R.F., Gurbel P.A., et al. Current and novel biomarkers of thrombotic risk in COVID-19: a Consensus Statement from the International COVID-19 Thrombosis Biomarkers Colloquium. Nat REV Cardiol. 2022; 19 (7): 475–95. https://doi.org/10.1038/s41569-021-00665-7.
28. Wallez Y., Huber P. Endothelial adherens and tight junctions in vascular homeostasis, inflammation and angiogenesis. Biochim Biophys Acta. 2008; 1778 (3): 794–809. https://doi.org/10.1016/j.bbamem.2007.09.003.
29. Levi M., van der Poll T. Inflammation and coagulation. Crit Care Med. 2010; 38 (2 Suppl.): S26–34. https://doi.org/10.1097/CCM.0b013e3181c98d21.
30. Libby P., Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J. 2020; 41 (32): 3038–44. https://doi.org/10.1093/eurheartj/ehaa623.
31. Макацария А.Д., Слуханчук Е.В., Бицадзе В.О. и др. Тромботический шторм, нарушения гемостаза и тромбовоспаление в условиях COVID-19. Акушерство, гинекология и репродукция. 2021; 15 (5): 499–514. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.247.
32. Stark K., Philippi V., Stockhausen S., et al. Disulfide HMGB1 derived from platelets coordinates venous thrombosis in mice. Blood. 2016; 128 (20): 2435–49. https://doi.org/10.1182/blood-2016-04-710632.
33. Ding J., Song B., Xie X., et al. Inflammation in cerebral venous thrombosis. Front Immunol. 2022; 13: 833490. https://doi.org/10.3389/fimmu.2022.833490.
34. Nieuwdorp M., van Haeften T.W., Gouverneur M.C.L.G., et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes. 2006; 55 (2): 480–6. https://doi.org/10.2337/diabetes.55.02.06.db051103.
35. Noubouossie D.F., Whelihan M.F., Yu Y.B., et al. In vitro activation of coagulation by human neutrophil DNA and histone proteins but not neutrophil extracellular traps. Blood. 2017; 129 (8): 1021–9. https://doi.org/10.1182/blood-2016-06-722298.
36. Blanch-Ruiz M.A., Ortega-Luna R., Gómez-García G., et al. Role of neutrophil extracellular traps in COVID-19 progression: an insight for effective treatment. Biomedicines. 2021; 10 (1): 31. https://doi.org/10.3390/biomedicines10010031.
37. Schurink B., Roos E., Radonic T., et al. Viral presence and immunopathology in patients with lethal COVID-19: a prospective autopsy cohort study. Lancet Microbe. 2020; 1 (7): e290–9. https://doi.org/10.1016/S2666-5247(20)30144-0.
38. Lim M.S., Mcrae S. COVID-19 and immunothrombosis: pathophysiology and therapeutic implications. Crit REV Oncol Hematol. 2021; 168: 103529. https://doi.org/10.1016/j.critrevonc.2021.103529.
39. Esmon C.T. Inflammation and the activated protein C anticoagulant pathway. Semin Thromb Hemost. 2006; 32 (Suppl. 1): 49–60. https://doi.org/10.1055/s-2006-939554.
40. Skendros P., Mitsios A., Chrysanthopoulou A., et al. Complement and tissue factor-enriched neutrophil extracellular traps are key drivers in COVID-19 immunothrombosis. J Clin INVEST. 2020; 130 (11): 6151–7. https://doi.org/10.1172/JCI141374.
41. Hamilton K.K., Hattori R., Esmon C.T., Sims P.J. Complement proteins C5b-9 induce vesiculation of the endothelial plasma membrane and expose catalytic surface for assembly of the prothrombinase enzyme complex. J Biol Chem. 1990; 265 (7): 3809–14.
42. Peerschke E.I., Yin W., Ghebrehiwet B. Complement activation on platelets: implications for vascular inflammation and thrombosis. Mol Immunol. 2010; 47 (13): 2170–5. https://doi.org/10.1016/j.molimm.2010.05.009.
43. Polley M.J., Nachman R. The human complement system in thrombinmediated platelet function. J Exp Med. 1978; 147 (6): 1713–26. https://doi.org/10.1084/jem.147.6.1713.
44. Verschoor A., Neuenhahn M., Navarini A.A., et al. A platelet-mediated system for shuttling blood-borne bacteria to CD8α+ dendritic cells depends on glycoprotein GPIb and complement C3. Nat Immunol. 2011; 12 (12): 1194–201. https://doi.org/10.1038/ni.2140.
45. Stark K., Massberg S. Interplay between inflammation and thrombosis in cardiovascular pathology. Nat REV Cardiol. 2021; 18 (9): 666–82. https://doi.org/10.1038/s41569-021-00552-1.
46. Magro C., Mulvey J.J., Berlin D., et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases. Transl Res. 2020; 220: 1–13. https://doi.org/10.1016/j.trsl.2020.04.007.
47. Fenyves B.G., Mehta A., Kays K.R., et al. Plasma P-selectin is an early marker of thromboembolism in COVID-19. Am J Hematol. 2021; 96 (12): E468–71. https://doi.org/10.1002/ajh.26372.
48. Barrett T.J., Lee A.H., Xia Y., et al. Platelet and vascular biomarkers associate with thrombosis and death in coronavirus disease. Circ Res. 2020; 127 (7): 945–7. https://doi.org/10.1161/CIRCRESAHA.120.317803.
49. Barrett T.J., Bilaloglu S., Cornwell M., et al. Platelets contribute to disease severity in COVID-19. J Thromb Haemost. 2021; 19 (12): 3139–53. https://doi.org/10.1111/jth.15534.
50. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID19). Версия 18 (26.10.2023). Министерство здравоохранения Российской Федерации. URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/064/610/original/D092D09CD0A0_COVID-19_V18.pdf (дата обращения 11.09.2023).
51. Lopes R.D., Silva P.G.M. de B e, Furtado R.H.M., et al. Therapeutic versus prophylactic anticoagulation for patients admitted to hospital with COVID-19 and elevated D-dimer concentration (ACTION): an open-label, multicentre, randomised, controlled trial. Lancet. 2021; 397 (10291): 2253–63. https://doi.org/10.1016/S0140-6736(21)01203-4.
52. Lawler P.R., Goligher E.C., Bergerigators J.S., et al. Therapeutic anticoagulation with heparin in noncritically ill patients with Covid-19. New Engl J Med. 2021; 385 (9): 790–802. https://doi.org/10.1056/NEJMoa2105911.
53. Goligher E.C., Bradbury C.A., McVerry B.J., et al. Therapeutic anticoagulation with heparin in critically ill patients with Covid-19. New Engl J Med. 2021; 385 (9): 777–89. https://doi.org/10.1056/NEJMoa2103417.
54. Farrar J.E., Trujillo T.C., Mueller S.W., et al. Evaluation of a patient specific, targeted-intensity pharmacologic thromboprophylaxis protocol in hospitalized patients with COVID-19. J Thromb Thrombolysis. 2022; 53 (2): 446–53. https://doi.org/10.1007/s11239021-02552-x.
55. Sofia R., Carbone M., Landoni G., et al. Anticoagulation as secondary prevention of massive lung thromboses in hospitalized patients with COVID-19. Eur J Intern Med. 2022; 100: 21–4. https://doi.org/10.1016/j.ejim.2022.04.009.
56. Spyropoulos A.C., Goldin M., Giannis D., et al. Efficacy and safety of therapeutic-dose heparin vs standard prophylactic or intermediatedose heparins for thromboprophylaxis in high-risk hospitalized patients with COVID-19: the HEP-COVID randomized clinical trial. JAMA Intern Med. 2021; 181 (12): 1612–20. https://doi.org/10.1001/jamainternmed.2021.6203.
57. Cuker A., Tseng E.K., Schünemann H.J., et al. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis for patients with COVID-19: March 2022 update on the use of anticoagulation in critically ill patients. Blood ADV. 2022; 6 (17): 4975-82. https://doi.org/10.1182/bloodadvances.2022007940.
58. Fragkou P.C., Palaiodimou L., Stefanou M.I., et al. Effects of low molecular weight heparin and fondaparinux on mortality, hemorrhagic and thrombotic complications in COVID-19 patients. Ther ADV Neurol Disord. 2022; 15: 17562864221099472. https://doi.org/10.1177/17562864221099472.
59. Leentjens J., van Haaps T.F., Wessels P.F., et al. COVID-19-associated coagulopathy and antithrombotic agents-lessons after 1 year. Lancet Haematol. 2021; 8 (7): e524–33. https://doi.org/10.1016/S23523026(21)00105-8.
60. Hong L., Chen G., Cai Z., et al. Balancing microthrombosis and inflammation via injectable protein hydrogel for inflammatory bowel disease. ADV Sci. 2022; 9 (20): e2200281. https://doi.org/10.1002/advs.202200281.
61. Patel B., Rashid J., Gupta N., Ahsan F. Low-molecular-weight heparincoated and montelukast-filled inhalable particles: a dual-drug delivery system for combination therapy in asthma. J Pharm Sci. 2017; 106 (4): 1124–35. https://doi.org/10.1016/j.xphs.2016.12.025.
62. Appiah D., Quinn N.J., Messing E.G., Veltri K.T. Safety and efficacy analysis of apixaban compared to heparins in hospitalized non-critically ill COVID-19 patients. Hosp Pharm. 2022; 57 (6): 727–33. https://doi.org/10.1177/00185787221095764.
63. Ji H.L., Dai Y., Zhao R. Fibrinolytic therapy for COVID-19: a review of case series. Acta Pharmacol Sin. 2022; 43 (8): 2168–70. https://doi.org/10.1038/s41401-021-00827-w.
64. Ji H.L., Zhao R., Matalon S., Matthay M.A. Elevated plasmin(ogen) as a common risk factor for COVID-19 susceptibility. Physiol REV. 2020; 100 (3): 1065–75. https://doi.org/10.1152/physrev.00013.2020.
65. Barrett C.D., Oren-Grinberg A., Chao E., et al. Rescue therapy for severe COVID-19-associated acute respiratory distress syndrome with tissue plasminogen activator: a case series. J Trauma Acute Care Surg. 2020; 89 (3): 453–7. https://doi.org/10.1097/TA.0000000000002786.
66. Renné T., Stavrou E.X. Roles of factor XII in innate immunity. Front Immunol. 2019; 10: 2011. https://doi.org/10.3389/fimmu.2019.02011.
67. Mailer R.K., Rangaswamy C., Konrath S., et al. An update on factor XII-driven vascular inflammation. Biochim Biophys Acta Mol Cell Res. 2022; 1869 (1): 119166. https://doi.org/10.1016/j.bbamcr.2021.119166.
68. Bikdeli B., Madhavan M.V., Jimenez D., et al. COVID-19 and thrombotic or thromboembolic disease: implications for prevention, antithrombotic therapy, and follow-up: JACC state-of-the-art review. J Am Coll Cardiol. 2020; 75 (23): 2950–73. https://doi.org/10.1016/j.jacc.2020.04.031.
69. Mackman N., Bergmeier W., Stouffer G.A., Weitz J.I. Therapeutic strategies for thrombosis: new targets and approaches. Nat REV Drug DISCOV. 2020; 19 (5): 333–52. https://doi.org/10.1038/s41573-0200061-0.
70. Aliter K.F., Al-Horani R.A. Potential therapeutic benefits of dipyridamole in COVID-19 patients. Curr Pharm Des. 2021; 27 (6): 866–75. https://doi.org/10.2174/1381612826666201001125604.
71. Nappi F., Giacinto O., Ellouze O., et al. Association between COVID-19 diagnosis and coronary artery thrombosis: a narrative review. Biomedicines. 2022; 10 (3): 702. https://doi.org/10.3390/biomedicines10030702.
72. Barnes B.J., Adrover J.M., Baxter-Stoltzfus A., et al. Targeting potential drivers of COVID-19: neutrophil extracellular traps. J Exp Med. 2020; 217 (6): e20200652. https://doi.org/10.1084/jem.20200652.
73. Veras F.P., Pontelli M.C., Silva C.M., et al. SARS-CoV-2-triggered neutrophil extracellular traps mediate COVID-19 pathology. J Exp Med. 2020; 217 (12): e20201129. https://doi.org/10.1084/jem.20201129.
74. Franzetti M., Forastieri A., Borsa N., et al. IL-1 receptor antagonist anakinra in the treatment of COVID-19 acute respiratory distress syndrome: a retrospective, observational study. J Immunol. 2021; 206 (7): 1569–75. https://doi.org/10.4049/jimmunol.2001126.
75. Cavalli G., Dagna L. The course of action for effective anti-cytokine treatment in COVID-19. Lancet Respir Med. 2021; 9 (12): 1353–4. https://doi.org/10.1016/S2213-2600(21)00405-7.
76. Kyriazopoulou E., Huet T., Cavalli G., et al. Effect of anakinra on mortality in patients with COVID-19: a systematic review and patientlevel meta-analysis. Lancet Rheumatol. 2021; 3 (10): e690–7. https://doi.org/10.1016/S2665-9913(21)00216-2.
77. Vora S.M., Lieberman J., Wu H. Inflammasome activation at the crux of severe COVID-19. Nat REV Immunol. 2021; 21 (11): 694–703. https://doi.org/10.1038/s41577-021-00588-x.
78. Matthay M.A., Luetkemeyer A.F. IL-6 receptor antagonist therapy for patients hospitalized for COVID-19: who, when, and how? JAMA. 2021; 326 (6): 483–5. https://doi.org/10.1001/jama.2021.11121.
79. Li X., Shao M., Zeng X., et al. Signaling pathways in the regulation of cytokine release syndrome in human diseases and intervention therapy. Signal Transduct Target Ther. 2021; 6 (1): 367. https://doi.org/10.1038/s41392-021-00764-4.
80. Guéant J., Guéant-Rodriguez R., Fromonot J., et al. Elastase and exacerbation of neutrophil innate immunity are involved in multivisceral manifestations of COVID-19. Allergy. 2021; 76 (6): 1846–58. https://doi.org/10.1111/all.14746.
81. Ruggenenti P., Di Marco F., Cortinovis M., et al. Eculizumab in patients with severe coronavirus disease 2019 (COVID-19) requiring continuous positive airway pressure ventilator support: retrospective cohort study. PLoS One. 2021; 16 (12): e0261113. https://doi.org/10.1371/journal.pone.0261113.
82. Rambaldi A., Gritti G., Micò M.C., et al. Endothelial injury and thrombotic microangiopathy in COVID-19: treatment with the lectinpathway inhibitor narsoplimab. Immunobiology. 2020; 225 (6): 152001. https://doi.org/10.1016/j.imbio.2020.152001.
83. Временные методические рекомендации. Медицинская реабилитация при новой коронавирусной инфекции (COVID-19). Версия 2 (31.07.2020). Министерство здравоохранения Российской Федерации. URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/051/187/original/31072020_Reab_COVID19_v1.pdf (дата обращения 11.09.2023).
Об авторах
К. Н. ГригорьеваРоссия
Григорьева Кристина Николаевна
Ул. Трубецкая, д. 8/2, Москва 119048
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы. Scopus Author ID: 57808783500.
Ул. Трубецкая, д. 8/2, Москва 119048
В. И. Цибизова
Россия
Цибизова Валентина Ивановна - к.м.н.
Ул. Аккуратова, д. 2, Санкт-Петербург 197341
Рецензия
Для цитирования:
Григорьева К.Н., Гашимова Н.Р., Цибизова В.И. Коррекция гемостаза в лечении и реабилитации пациентов с COVID-19. Реабилитология. 2023;1(1):49-59. https://doi.org/10.17749/2949-5873/rehabil.2023.3
For citation:
Grigoreva К.N., Gashimova N.R., Tsibizova V.I. Hemostasis correction in the treatment and rehabilitation of COVID-19 patients. Journal of Medical Rehabilitation. 2023;1(1):49-59. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2023.3






