Перейти к:
Маршрутизация пациенток при реабилитации после лечения онкогинекологических патологий
https://doi.org/10.17749/2949-5873/rehabil.2024.21
Аннотация
Актуальность. В последние годы онкогинекологические заболевания у женщин репродуктивного возраста диагностируются все чаще. Несмотря на высокую эффективность лечения, в системе реабилитации таких пациенток отмечаются значительные недостатки.
Цель: представить преемственность и особенности системы реабилитации у пациенток онкогинекологического профиля.
Материал и методы. В обзор вошло 75 публикаций из авторитетных источников, соответствующих теме и представляющих уникальные выводы. Поиск статей проведен в отечественных и иностранных онлайн-библиотеках, базах данных и поисковых системах. Поиск и скрининг осуществлены в соответствии с рекомендациями PRISMA.
Результаты. Пациенткам с онкогинекологическими заболеваниями необходимо уделять особое внимание при оказании медицинской помощи на восстановительном этапе. Важно соблюдать принцип преемственности между всеми этапами системы реабилитации – сразу после проведения лечения, в отделении реабилитации и амбулаторно. Данная система разработана в России, однако требует масштабирования и решения целого ряда проблем – от недостатка врачей-реабилитологов, ограниченности применения перспективных методов реабилитации до неполной психологической поддержки и отсутствия общепринятой системы комплексной реабилитации. При этом для оказания узкоспециализированной помощи существует достаточно много как традиционных, так и высокотехнологичных инструментов.
Заключение. Агрессивное лечение онкогинекологических заболеваний пагубно влияет на общее самочувствие женщины, значительно снижая качество жизни. Ранее реабилитационную помощь сильно затрудняла закостенелость системы как на методическом, так и на административном уровне. В последнее время произошли положительные сдвиги в решении проблем оказания помощи пациенткам онкогинекологического профиля, однако для качественного изменения ситуации представленных мер недостаточно.
Ключевые слова
Для цитирования:
Акавова С.А. Маршрутизация пациенток при реабилитации после лечения онкогинекологических патологий. Реабилитология. 2024;2(1):158-172. https://doi.org/10.17749/2949-5873/rehabil.2024.21
For citation:
Akavova S.A. Patient routing system in rehabilitation after treatment for oncogynecological pathologies. Journal of Medical Rehabilitation. 2024;2(1):158-172. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.21
ВВЕДЕНИЕ / INTRODUCTION
В настоящее время наблюдается заметный рост заболеваемости злокачественными новообразованиями (ЗНО) женской репродуктивной системы. Кроме того, увеличивается распространенность онкологических патологий среди молодых женщин репродуктивного возраста [1][2]. Несмотря на развитие методов диагностики и лечения, рак шейки матки (РШМ) остается серьезной проблемой для мирового медицинского сообщества.
В 2022 г. РШМ являлся одним из распространенных видов ЗНО в России: 126,87 случая на 100 тыс. населения, или 4,7% от всех случаев онкологических заболеваний среди женщин [3]. По данным Всемирной организации здравоохранения за 2020 г., заболеваемость РШМ в Российской Федерации составляла 19,7 на 100 тыс. населения. Этот показатель варьировался в зависимости от региона от 10,2 случая на 100 тыс. населения в Северной Европе до 18,2 случая на 100 тыс. населения в Юго-Восточной Европе [4]. Такое несоответствие может быть объяснено различиями в диагностике патологии, доступности вакцинации против вируса папилломы человека (ВПЧ) и доступе к хирургическим методам лечения в разных странах. За 10 лет (с 2008 по 2018 гг.) заболеваемость РШМ выросла на 22,3% [4]. Примечательно, что это увеличение в первую очередь наблюдается среди пациенток в возрасте от 40 до 49 лет. Аналогичным образом, уровень смертности от РШМ увеличился на 85,2% среди женщин в возрасте от 35 до 59 лет за 20-летний период. Во всем мире показатель смертности от РШМ составляет 3,4%, на его долю приходится 7,7% всех смертей, обусловленных онкопатологией [2].
Среди нерешенных медицинских проблем, связанных с РШМ, остается несвоевременное выявление данного заболевания и его лечение. Проблемы носят многогранный характер: несвоевременное обращение женщин за медицинской помощью, отсутствие преемственности между амбулаторно-стационарными и лечебно-профилактическими учреждениями, ограниченный доступ к диагностическим методам, неадекватное ведение пациенток на всех этапах диагностики, лечения и профилактики, а также на стадии восстановления. Разработка корректной стратегии по устранению этих препятствий не только сократит время ожидания, но и улучшит результаты лечения пациенток с РШМ, что в совокупности снизит нагрузку на систему здравоохранения [5].
Цель – представить преемственность и особенности системы реабилитации в оказании помощи пациенткам онкогинекологического профиля.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
Проанализированы данные, полученные из онлайн-библиотек Cochrane Library, eLibrary, КиберЛенинка, научных баз данных PubMed/MEDLINE, Google Scholar, ScienceDirect. Поиск нормативной документации проводили с помощью систем КонсультантПлюс, Кодекс, КонтурНорматив, текстов клинических рекомендаций – с помощью Рубрикатора клинических рекомендаций Минздрава России. Остальные источники информации получены через поисковые сервисы Google и Яндекс.
Рассматривали публикации на русском и английском языках, найденные по запросам: «маршрутизация пациентов», «онкология», «реабилитация», «гинекология», «приказы и законы», «проблемы реабилитации», «восстановительная медицина», «онкогинекология», “patient routing”, “oncology”, “rehabilitation”, “gynecology”, “orders and laws”, “problems of rehabilitation”, “rehabilitation medicine”, “oncogynecology”. Дальнейший отбор материалов проводили с учетом рекомендаций PRISMA.
Скрининг / Screening
По указанным запросам выявлено 5113 публикаций, относящихся к области онкологии и реабилитации. Процедура отсева по названиям, которые однозначно относятся к теме ведения пациенток онкологического профиля на восстановительном этапе, позволила исключить из анализа 4517 статей.
На этапе скрининга рассматривалось 596 материалов. Все они были проверены на предмет совпадения названий, в результате чего было исключено 26 дублирующих работ. Из оставшихся 570 публикаций для 139 не был получен доступ к полным текстам. Затем проводили подробное ознакомление с каждым текстом на предмет соответствия теме обзора, оценивали авторитетность источника и уникальность представленных авторами выводов. После скрининга в анализ включено 75 публикаций, которые полностью соответствовали критериям отбора.
Общая схема проведенного скрининга приведена на рисунке 1.
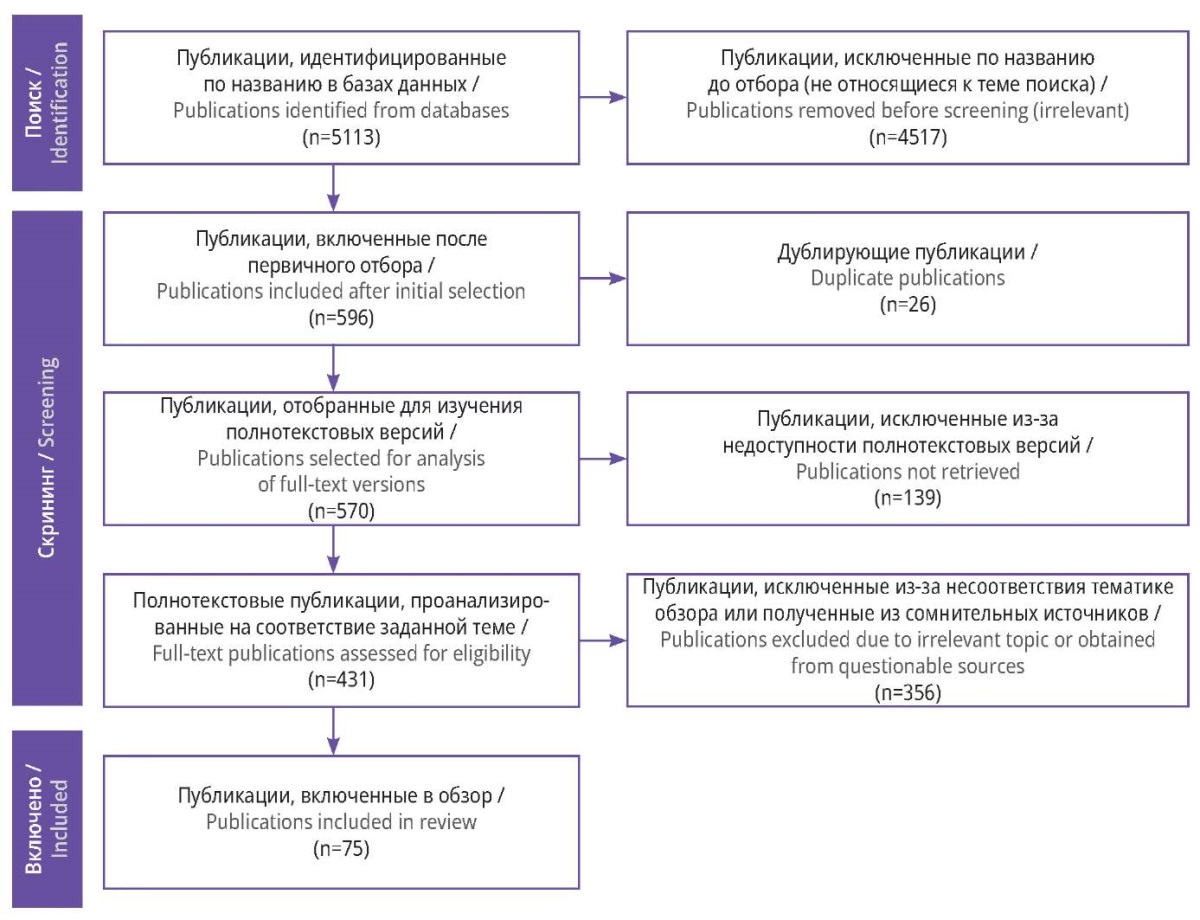
Рисунок 1. Блок-схема отбора публикаций с учетом рекомендаций PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews
and Meta-Analyses) workflow for selection of publications
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Маршрутизация пациенток с РШМ на примере опыта г. Москвы / Routing of cervical cancer patients on the example of Moscow experience
Пациентки, у которых диагностирован РШМ, должны быть должным образом проинформированы, чтобы понимать, какие шаги нужно предпринять дальше, поскольку нередко им приходится самостоятельно ориентироваться в этой сложной ситуации. Для обеспечения должного руководства и понимания структуры оказания помощи должны быть зарегламентированы этапы маршрутизации больных с определением четких правил направления женщин с РШМ и сроков каждого этапа лечения. Департаментом здравоохранения г. Москвы были предприняты попытки регламентирования данного процесса [6][7].
Условия маршрутизации, созданные для больных РШМ в г. Москве, гарантируют, что пациентки получают комплексную и своевременную помощь на протяжении всего пути. От диагностики до лечения и последующего наблюдения различные медицинские учреждения и специалисты работают вместе, чтобы обеспечить наилучшие результаты. Данные послеоперационных патогистологических исследований анализируются, и в центре амбулаторной онкологической помощи (ЦАОП) проводится консультация с онкологом для осуществления мониторинга лечения и своевременной коррекции оказания медицинской помощи. После того как диагноз РШМ подтверждается гистологически, созывается мультидисциплинарная бригада, чтобы определить оптимальный план действий.
ГБУЗ «Городская клиническая онкологическая больница № 1 Департамента здравоохранения г. Москвы» (ГКОБ № 1) отвечает за проведение радикального хирургического лечения на начальном этапе по рекомендации онкологического консилиума. По истечении 12-месячного периода наблюдения при отсутствии признаков рецидива выполняются дальнейшие обследования в медицинском учреждении, оказывающем первичную специализированную помощь. Приказом Департамента здравоохранения г. Москвы от 11 сентября 2020 г. № 1032 регламентирован перечень и периодичность контрольных осмотров [6]. Разработка данных маршрутов ведется в соответствии с приказом Департамента здравоохранения г. Москвы от 14 января 2022 г. № 16 [7], который гарантирует, что пациентки будут получать последовательную и комплексную помощь на протяжении всего пути.
На этапе диагностики больные направляются в ЦАОП ГКОБ № 1, находящейся в ведении Департамента здравоохранения г. Москвы. Здесь они проходят ряд обследований, необходимых для подтверждения диагноза и определения соответствующего плана лечения. После успешного завершения специализированной противоопухолевой терапии пациентки переходят в третью клиническую группу и находятся на пожизненном наблюдении. ЦАОП отвечает за назначение и проведение последующих обследований в течение первых 12 мес после завершения лечения.
С учетом важности психологической поддержки в ЦАОП ГКОБ № 1 открыт кабинет психолога для оказания специализированной помощи больным на любом этапе процесса диагностики. Психологическая поддержка направлена на улучшение качества жизни (КЖ) пациенток в это непростое для них время.
Диагностика и лечение пациенток с РШМ / Diagnosis and treatment of cervical cancer patients
Постановка диагноза
Чтобы диагностировать РШМ, медицинские работники проводят тщательный анализ истории болезни пациентки, в частности выявляют любые признаки аномального маточного кровотечения в репродуктивном периоде или после менопаузы. Дополнительно проводится физикальный гинекологический осмотр.
Инструментальные методы, такие как ультразвуковое исследование (УЗИ) и магнитно-резонансная томография (МРТ) с контрастированием органов малого таза, используются для сбора ценной информации о первичной опухоли и ее распространенности. Однако для подтверждения диагноза необходимо гистологическое исследование, которое включает анализ образца ткани, взятого во время биопсии или хирургического вмешательства, чтобы установить, имеет ли место онкогинекологическая патология, определить конкретный тип рака и стадию заболевания, оценить его дифференцировку, измерить глубину инвазии [8].
Стадию РШМ определяют по классификации Международной федерации гинекологии и акушерства (франц. Fédération Internationale de Gynécologie et d'Obstétrique, FIGO) 2019 г. [9], а также по системе TNM (англ. tumor, nodus и metastasis) 8-го издания (2016 г.) [10].
Лечение
Хирургические методы
РШМ распространен среди женщин репродуктивного возраста. Радикальная хирургическая операция может оказать разрушительное влияние на социальную составляющую их жизни (создание семьи и планирование материнства), а также на их восприятие собственного тела и женственности. Этим объясняется рост популярности органосохраняющих операций [11].
Одной из таких модификаций является радикальная вагинальная трахелэктомия (РВТ), заключающаяся в одновременной резекции шейки матки, влагалищной манжетки и параметральной клетчатки с последующей тазовой лимфаденэктомией и ушиванием маточно-влагалищного анастомоза. Эта процедура позволяет сохранить возможность будущей беременности и вынашивания ребенка. РВТ обладает несколькими преимуществами по сравнению с другими хирургическими методами. Данный вариант лечения имеет меньшую частоту послеоперационных осложнений, что делает его более предпочтительным для женщин молодой возрастной группы. Проведение РВТ показало хорошие долгосрочные результаты с точки зрения общей выживаемости пациенток с РШМ на ранней стадии [12–14].
В свою очередь, тотальная гистерэктомия является стандартным методом лечения больных РШМ. Объем операции и другие аспекты плана лечения зависят от стадии заболевания, риска его прогрессирования, наличия сопутствующих патологий и индивидуальных параметров пациентки. В случаях, когда риск прогрессирования РШМ стадии IIB низкий или средний, радикальная гистерэктомия является минимальным рекомендуемым хирургическим вмешательством [8][15].
Химиолучевая и иммунная терапия
В ситуациях, когда наблюдается обширный рост раковых клеток, проникающих глубоко в окружающие ткани (строма, параметрий и лимфоваскулярное пространство), и присутствуют такие неблагоприятные факторы, как большой размер опухоли и неадекватная резекция краев первичного поражения, пациенткам часто предлагают адъювантное лечение РШМ с использованием химиолучевой терапии. Этот комбинированный подход в настоящее время рекомендован североамериканским Национальным институтом онкологии (англ. National Cancer Institute, NCI) из-за его положительного влияния на общую выживаемость пациенток, страдающих РШМ [16].
Растет интерес к оптимизации лечения местнораспространенного РШМ с выходом за рамки стандартной химиолучевой терапии, которая использовалась в течение последних трех десятилетий [17]. Персистирующая инфекция ВПЧ высокого онкогенного риска часто связана с РШМ, поскольку продуцируемые ей вирусные онкопротеины могут вызывать клеточные изменения, в т.ч. иммортализацию. Это может привести к развитию иммунной толерантности и инициации злокачественного процесса [18]. Понимание механизма ВПЧ-зависимого онкогенеза позволило использовать иммунную терапию и блокаду иммунных контрольных точек как потенциальные способы настройки иммунного ответа организма [7].
В настоящее время проводятся многочисленные исследования, в которых изучается терапевтический потенциал этих подходов к лечению онкологических заболеваний [19–21]. Микросателлитная нестабильность (МСН), указывающая на высокую вероятность злокачественной патологии шейки матки, считается неблагоприятным прогностическим фактором [22]. Кроме того, мутации, в частности связанные с МСН, делают эти опухоли иммуногенными. Поэтому для улучшения результатов лечения разрабатываются комбинированные стратегии иммуномодуляции, включающие химиотерапию, лучевую терапию, иммунотерапию и ингибиторы иммунных контрольных точек.
Комбинация химиотерапевтического препарата цисплатин с иммунотерапией бевацизумабом считается вариантом первой линии лечения метастатического или рецидивирующего РШМ. Эффективность добавления бевацизумаба к химиотерапии была продемонстрирована в исследовании GOG 240: показаны уровень ответа 36–48% и увеличение выживаемости на 17 мес. Несмотря на многообещающие результаты изучения иммунотерапии и ее различных комбинаций, использование этих методов остается спорным и необходимы дальнейшие исследования [23].
Последствия противоопухолевого лечения / Complications of antitumor treatment
Выявление онкологического заболевания для женщины становится серьезным вызовом, оказывающим разрушительное воздействие на ее жизнь в целом [24]. В связи с этим крайне важно осуществлять психотерапевтическую поддержку с момента постановки диагноза, еще до начала хирургического лечения или химиолучевой терапии. Указанные методы лечения, особенно радикальные хирургические операции, зачастую являются причиной серьезных осложнений, негативно влияющих на эмоциональное и социальное благополучие, включая трудоспособность, общее состояние здоровья, образ тела, сексуальную функцию. Затрагиваются все аспекты жизни женщины, что приводит к значительному снижению общего КЖ. Учитывая эти пагубные последствия, необходимо реализовывать комплексную программу реабилитации, направленную на восстановление не только физического состояния, но и психического, социального и сексуального благополучия [25].
Постовариэктомический синдром
К одним из тяжелых осложнений радикального хирургического лечения гинекологических заболеваний, включая овариоэктомию, относят развитие постовариэктомического синдрома (ПОЭС). Данное состояние особенно распространено у женщин детородного возраста, поскольку внезапное удаление репродуктивных желез, ответственных за выработку женских половых гормонов, нарушает гормональную регуляцию и истощает защитные и адаптационные ресурсы организма. Это приводит к тому, что обычно называют хирургической менопаузой.
ПОЭС характеризуется развитием у пациенток генитоуринарного синдрома, который включает по меньшей мере три группы симптомов: вульвовагинальная атрофия, урологическая дисфункция и сексуальная дисфункция. Кроме того, у женщин с ПОЭС отмечают повреждения вегетативной нервной системы, метаболические и нервно-психические расстройства. Также нарушается целостность эпителия мочеполовых путей, который становится более восприимчивым к инфицированию условно-патогенными и патогенными бактериями за счет изменения местного микробиоценоза. Как следствие, рецидивирующая инфекция еще больше снижает КЖ пациенток [26].
Лимфедема
Лимфедема − осложнение, часто наблюдаемое в случаях радикальной гистерэктомии, особенно при выполнении расширенной лимфаденэктомии. Это изнурительное состояние, поражающее нижние конечности. Его начало обычно приходится на 3–6-й месяцы после хирургической процедуры. На развитие лимфедемы указывает ряд симптомов, включающих боль, отек, ограничение подвижности и чувствительности. Как следствие, женщины часто испытывают снижение уверенности в себе и отказываются от социальных взаимодействий, постепенно изолируя себя от окружения [27].
Поздние осложнения лучевой терапии
Поздние лучевые поражения органов малого таза у больных РШМ после лучевой и химиолучевой терапии встречаются с различной частотой − от 5 до 80% [28–30]. Такой широкий диапазон встречаемости обусловлен отсутствием согласованных критериев оценки радиационных нарушений.
Некоторые исследовантели к указанным осложнениям относят только тяжелые патологии, такие как язвы и свищи, тогда как другие рассматривают все осложнения, включая более легкие формы. Обычно поражаются органы вблизи облученной области – влагалище, мочевой пузырь и ректосигмовидная кишка. На развитие этих повреждений влияют такие факторы, как общая доза облучения, объем пораженных тканей, режим фракционирования, способ доставки излучения и индивидуальная чувствительность. Хронические заболевания, ранее имевшиеся расстройства мочевого пузыря, влагалища или кишечника, предыдущие операции на брюшной полости или лучевая терапия также представляют собой факторы риска возникновения осложнений.
Отличительной особенностью поздних лучевых поражений является образование радиационно-индуцированного фиброза, который создает фиброзный слой внутри пораженного органа и может привести к телеангиэктазиям, кровоизлияниям и чрезмерному кровотечению. По мере прогрессирования фиброза и повреждения всей стенки органа клинические симптомы ухудшаются [28–30]. Поэтому решающее значение имеет мультидисциплинарный подход к диагностике и реабилитации пациенток онкогинекологического профиля, включающий хирургическое и консервативное лечение, реконструктивно-пластическую хирургию и паллиативную помощь.
Сексуальная дисфункция
Сексуальная дисфункция – это осложнение, которое возникает в ответ на физические недуги, психологические и эмоциональные страдания и проявляется существенным падением сексуальной активности. Особенностью диагностики данного осложнения состоит в том, что общение с женщинами на тему сексуального здоровья затруднено, т.к. данная тема, по мнению пациенток, является табуированной. Страх боли, отсутствия удовольствия, телесных изменений и опасения по поводу своей привлекательности могут помешать женщине вступить в половой акт с партнером. Эти проблемы существенно влияют на личные отношения, общее психическое благополучие, настроение и КЖ пациентки [31][32].
Оценка КЖ после лечения РШМ / Quality of life assessment after treatment for cervical cancer
Субъективные методы
Оценку КЖ пациенток нередко проводят субъективным методом с помощью специализированных анкет, содержащих разнообразные тематические вопросы. В данных опросниках каждому ответу присваивается определенное количество баллов, а затем общая оценка интерпретируется по соответствующим шкалам.
В области гинекологической онкологии специалисты здравоохранения обычно используют опросник по качеству жизни (англ. Core Quality of Life Questionnaire, QLQ-C30) Европейской организации исследования и лечения рака (англ. European Organization for Research and Treatment of Cancer, EORTC), а также его модифицированную версию для РШМ, известную как EORTC QLQ-CX24 [33]. Кроме того, для анализа физического, эмоционального и социального благополучия применяют опросник для общей оценки функционального состояния при лечении рака (англ. Functional Assessment of Cancer Therapy – General, FACT-G) [34].
Скрининг на субклинические или клинические тревожные расстройства и депрессию проводят с помощью госпитальной шкалы тревоги и депрессии (англ. Hospital Anxiety and Depression Scale, HADS), которая классифицирует баллы от 0 до 7 как «нормальные», а баллы 8 или выше как индикаторы психологических проблем. Анкета для расчета индекса женской сексуальной функции (англ. Female Sexual Function Index, FSFI) используется с целью оценки сексуального функционирования женщин и позволяет определить частоту и выраженность сексуального желания, возбуждения, лубрикации, удовлетворения, оргазма, а также дискомфорт и боль во время полового акта. Наконец, в процессе оценки также применяется опросник САН (самочувствие, активность, настроение) [35–37].
Объективные методы
Инструменты для объективной оценки состояния пациенток при гинекологическом раке во время лечения и выздоровления представлены несколько скуднее. К объективным методам относят измерение различных антропометрических данных, таких как индекс массы тела, окружность талии и бедер.
Кроме того, ценную информацию могут дать анализ уровня pH и вагинальной микробиоты, проведение УЗИ и МРТ органов малого таза и брюшной полости, а также выполнение лабораторных анализов крови. Лабораторные тесты могут включать определение уровней фактора некроза опухоли альфа, интерлейкина-6, ракового эмбрионального антигена и опухолевых маркеров CA-125 и CA-19.9 в сыворотке крови.
Помимо вышеперечисленного, для оценки результатов лечеия РШМ можно использовать специфические маркеры, такие как антиген плоскоклеточного рака (англ. squamous cell carcinoma, SCC) и онкопротеин p16INK4a. Антиген SCC особенно важен, поскольку он демонстрирует уровень дифференцировки клеток и может указывать на рецидив или прогрессирование заболевания. В свою очередь, обнаружение онкопротеина p16INK4a связано с возможным наличием эпителиальной дисплазии шейки матки [38][39].
Проблемы реабилитации онкогинекологических больных / Problems of rehabilitation for oncogynecological patients
В настоящее время накоплены обширные знания об этиопатогенезе, факторах риска, клинических характеристиках, методах исследования и вариантах лечения заболеваний, поражающих репродуктивные органы. Однако пациенткам после успешного лечения уделяется ограниченное внимание, поскольку текущие рекомендации по реабилитации таких больных содержат скорее общий подход, без однозначного указания на персонифицированную помощь. Очевидно, что все онкогинекологические пациентки нуждаются в постоянной индивидуальной медицинской и социальной поддержке после противоопухолевой терапии, поскольку у них часто возникают анатомо-физиологические нарушения, психологические сложности, проблемы взаимоотношений в семье и на работе. Эти факторы существенно снижают их КЖ и безусловно требуют помощи специалистов из разных сфер [3][8][40].
Сегодня ЗНО считаются социально значимыми заболеваниями из-за их высокой распространенности, уровня инвалидности и смертности в большинстве стран мира. Среди онкологических патологий примерно 40% опухолей встречаются в репродуктивной системе. Поразительно, но только в 2018 г. во всем мире было диагностировано более 3 млн новых случаев онкогинекологических заболеваний, что привело к более чем 1 млн смертей [41]. В последние годы в России наблюдается устойчивый рост случаев заболеваний такого профиля. Однако наметилась тенденция к снижению уровня смертности, что можно объяснить внедрением программ скрининга, профилактических осмотров и развитием подходов к диагностике и лечению. Все больше женщин репродуктивного возраста обследуются и диагностируются на более ранних стадиях, что способствует благоприятному прогнозу.
Учитывая распространенность онкогинекологических заболеваний и то, что многие заболевшие женщины находятся в репродуктивном и трудоспособном возрасте, появляется необходимость в развитии реабилитологии в теоретической и практической областях. В практической области проводят постепенное внедрение комплексной реабилитационной помощи, которая должна быть доступна всем людям, независимо от их социального статуса, финансовых возможностей и места жительства. Реабилитационные мероприятия следует осуществлять в полном объеме с учетом рекомендаций и результатов последних исследований. Однако на текущий момент оказание реабилитационной помощи женщинам с онкогинекологическими заболеваниями упирается в ряд проблем.
Отсутствие комплексной системы реабилитации
Препятствием в развитии восстановительной помощи в гинекологической онкологии является отсутствие программ подготовки медицинских кадров в этой специфической области. Лишь в 2018 г. был утвержден стандарт «Специалист по медицинской реабилитации» [42]. Кроме того, принята Национальная стратегия борьбы с раком на долгосрочный период до 2030 года [43].
В России уже предпринимаются попытки внедрения комплексного подхода в сфере медицинской реабилитации. Он представляет собой трехэтапную модель оказания услуг медицинской реабилитации, включая интенсивную терапию, стационарную помощь и амбулаторную помощь с участием многопрофильных бригад. В настоящее время не существует установленных узкоспециализированных рекомендаций по оказанию восстановительной помощи при онкогинекологических заболеваниях. Это можно объяснить отставанием в развитии реабилитации в системе здравоохранения по сравнению с другими странами.
Лишь в 2011 г. понятие «медицинская реабилитация» было законодательно определено на государственном уровне Федеральным законом от 21 ноября 2011 г. № 323-ФЗ, направленным на защиту здоровья граждан [44]. Впоследствии Минздрав России издал приказы №№ 1705н, 788Н и 878Н, в которых определен порядок организации медицинской реабилитации [45–47].
Кроме того, существуют разногласия среди врачей относительно сфер их ответственности, нехватка коек для онкогинекологических больных, нуждающихся в восстановительной помощи, неполная осведомленность о злокачественности заболевания, недостаточность критериев оценки реабилитационного потенциала. В совокупности эти факторы обусловливают низкую эффективность принимаемых мер по оказанию восстановительной помощи. Отсутствие комплексного и мультидисциплинарного подхода приводит к повышению риска инвалидизации женщин, прошедших специализированное противоопухолевое лечение онкогинекологических заболеваний.
Труднодоступность медицинской реабилитации
Текущее состояние реабилитационных услуг характеризуется частым отсутствием участия врачей-реабилитологов. Вместо этого пациенткам помогают лечащие врачи-онкологи, которые могут не обладать необходимым опытом в области восстановительных мероприятий, поскольку это выходит за рамки их основных обязанностей. Как следствие, начало реабилитации часто откладывается, что в конечном итоге снижает вероятность успешного выздоровления. Важно отметить, что в нашей стране относительно мало реабилитационных центров [48]. Эти медицинские учреждения обычно расположены недалеко от крупных городов и, как правило, требуют оплаты за свои услуги.
Для больных гинекологической онкологией в настоящее время не существует специализированных учреждений, отвечающих их конкретным потребностям. Женщины, прошедшие противоопухолевое лечение по поводу заболеваний органов репродуктивной системы, нередко вынуждены самостоятельно решать свои проблемы, что приводит к развитию существенных осложнений, сложно поддающихся лечению, и снижению общего КЖ [49].
Ограниченность применения методов реабилитации
В течение значительного периода времени при обследовании больных с целью определения противопоказаний к восстановительным мероприятиям особое внимание уделялось анамнезу, в частности заболеваниям репродуктивной системы, эндокринным нарушениям и онкологическим патологиям. Эти заболевания считались «красными флажками» для врачей-реабилитологов, что приводило к запрету использования отдельных инструментов реабилитации на основании отсутствия достаточной доказательной базы. Недавние исследования в области реабилитации пациенток расширили ранее скудную доказательную базу применения отдельных инструментов реабилитации [50][51]. Несмотря на это, многие медицинские организации до сих пор придерживаются старого подхода, избегая «ненужных» процедур, чтобы минимизировать потенциальный вред, в результате чего значительная часть пациенток не получает комплексной помощи.
Отсутствие мероприятий по пререабилитации
В свете вышеуказанных недостатков системы реабилитации роль врачей поликлинического звена становится особенно значимой. Они не только диагностируют заболевание, но и оценивают КЖ пациентки. На основании полученных результатов можно определить физиологическое и психологическое состояние больной и начать соответствующие пререабилитационные мероприятия. Зачастую именно специалист, первым выявляющий наличие злокачественного процесса, например акушер-гинеколог, онколог или хирург, задает тон настрою пациентки на выздоровление и ее участию в процессе выздоровления.
Еще одна актуальная проблема, с которой сталкиваются онкогинекологические больные, – истощенные внутренние резервы и подавленное психологическое состояние перед началом специализированного противоопухолевого лечения. Несмотря на необходимость начинать лечение как можно скорее, не менее важна должная подготовка пациенток к этой процедуре путем восстановления адаптационных резервов при прохождении пререабилитации. Тем самым достигается снижение риска надрыва состояния здоровья, который может сопровождаться комплексом осложнений, напрямую являющихся следствием лечения.
В настоящее время основное внимание в реабилитационной помощи больным гинекологическим раком уделяется разработке клинических рекомендаций, которые можно использовать после противоопухолевого лечения. Однако крайне важно понимать, что пациенткам необходима поддержка на всех этапах их медицинского пути. Концепция, известная как «пререабилитация», предполагает оказание постоянной помощи больным с момента постановки диагноза до начала лечения [5][52].
Особые анатомо-физиологические изменения у онкогинекологических больных
У женщин с опухолями репродуктивной сферы имеются многочисленные анатомо-физиологические и психологические особенности, препятствующие сохранению высокого КЖ [53]. Помимо общих жалоб, с которыми сталкиваются все онкологические больные, у таких пациенток возникают специфические проблемы.
Эмоциональное воздействие от полного или частичного повреждения тканей, наличия рубцов может быть разрушительным. Женщины, имеющие внешние дефекты, например рубцы, часто отмечают снижение самооценки и развитие комплексов, связанных с внешностью. Эти проблемы также могут привести к отказу от половой жизни [54].
Кроме указанных анатомических дефектов, существенно сказываются на КЖ пациенток следующие осложнения: постовариэктомический синдром, болевой синдром, генитоуринарный менопаузальный синдром, депрессивные расстройства, а также отдельные метаболические и эндокринные нарушения (ожирение, гиперхолестеринемия). Все эти изменения являются специфичными и требуют высокой квалификации персонала для своевременного выявления и купирования осложнения [55].
Недостаточный объем психологической и психотерапевтической помощи
Больным онкогинекологического профиля требуется оказание не только своевременного и адекватного лечения, но и специфичной реабилитации, направленной на восстановление и поддержание их КЖ. Психологическая реабилитация играет важную роль в решении данной проблемы, помогая женщинам, страдающим онкогинекологическими заболеваниями, адаптироваться к новому состоянию и понять необходимость проведения лечения и реабилитации. Страх инвалидности, социальной изоляции и смерти может привести к проблемам с психическим здоровьем, дезадаптации и негативным эмоциональным потрясениям. Эти проблемы могут различаться в зависимости от личностных характеристик женщины, стадии и типа лечения, возраста и других социально-психологических факторов.
Онкологические заболевания у женщин не только влияют на их физическое здоровье, но и затрагивают важные аспекты, связанные с сексуальной жизнью, репродуктивной функцией и семейными отношениями. Для пациенток детородного возраста проблема становится еще более актуальной, если они до болезни не рассматривали возможность рождения детей. Больные гинекологическим раком часто воспринимают радикальные операции как форму «кастрации», а медицинские вмешательства на интимных участках тела для них связаны с сильными личными переживаниями. Психологическая реабилитация таких пациенток должна учитывать их глубоко укоренившиеся эмоции и самовосприятие. Самосознание играет решающую роль в том, как больные воспринимают свое заболевание и лечение, что в конечном итоге влияет на КЖ.
Рак репродуктивной системы оказывает серьезное психологическое воздействие на женщину, создавая кризисную ситуацию, в которую вовлечены члены ее семьи, особенно муж. Поэтому важно предоставлять консультации и поддержку ближайшим родственникам пациентки, помогая им ориентироваться в новой динамике, вызванной болезнью. Еще одной серьезной психологической проблемой является «синдром выгорания»: если пациентки не видят желаемых результатов, они могут потерять веру в предлагаемое лечение и вообще отказаться от помощи врачей. В таких случаях решающее значение имеют скоординированные усилия врачей разного профиля, в т.ч. специалистов по онкологической реабилитации и психологов-онкологов. Их ключевая роль заключается в информировании пациенток о том, что гинекологический рак – это не смертный приговор, а скорее диагноз, который все еще может позволить им жить полноценной жизнью. Однако социальная канцерофобия и другие психологические проблемы, с которыми сталкиваются онкогинекологические больные, часто связаны с недостаточной осведомленностью населения в целом и нехваткой профессиональных психологических услуг [56][57].
Диагностика и профилактика рецидивов
Профилактика рецидивов рака репродуктивной системы имеет решающее значение для успешной реабилитации. Отсюда вытекает потребность в разработке методов диагностики, позволяющих как можно раньше выявить, подтвердить или опровергнуть рецидив онкологического заболевания. Кроме того, важно понимать, что любой раковый процесс истощает внутренние резервы организма. Поэтому на этапе реабилитации следует уделять особое внимание иммунному статусу женщины и при необходимости рекомендовать иммуномодулирующую терапию с учетом проведенного ранее лечения.
Одним из препятствий для ранней диагностики является снижение осведомленности о раке среди пациенток, прошедших терапию опухолей репродуктивной системы. С течением времени женщины склонны забывать о важности регулярного наблюдения за своим здоровьем, что заставляет их рассматривать более агрессивное лечение при возникновении рецидива [58–60].
Реабилитация пациенток после лечения РШМ / Rehabilitation of patients after treatment for cervical cancer
На самочувствие больных РШМ влияют различные факторы, которые обусловливают необходимость комплексного междисциплинарного подхода к их реабилитации. Основополагающие принципы организации реабилитации онкогинекологических больных предусматривают формирование мультидисциплинарной команды, оперативное устранение социальных и психологических дезадаптаций, контроль общего самочувствия и КЖ пациентки на протяжении всего лечения, разработку индивидуальных реабилитационных мероприятий [61]. Эта программа направлена на изменение образа жизни, оказание психотерапевтической поддержки, использование климато- и ландшафтной терапии, укрепление мышц тазового дна, внедрение терапии биологической обратной связи и использование различных физиотерапевтических методов, таких как гипербарическая оксигенация, магнитотерапия, электросон и ксеноновая терапия.
Модификация образа жизни
Решающий шаг в улучшении образа жизни включает соблюдение разнообразной и сбалансированной диеты, богатой необходимыми витаминами и микроэлементами. Это должно сопровождаться получением надлежащей питательной поддержки и решением проблем с весом в случаях ожирения. Кроме того, важно увеличивать физическую активность путем занятий йогой, аэробикой, плаванием и пилатес, а также с помощью групповых кардиотренировок. Важно соблюдать адекватное соотношение труда и отдыха с целью обеспечения качественного сна и выделения времени для прогулок на свежем воздухе. Для общего благополучия также рекомендуется минимизировать внешние стрессоры и дискомфорт [51][62].
Высокоэффективным является подход к реабилитации, совмещающий улучшение как физического, так и эмоционального состояния. Данный подход, например, предполагает участие в контролируемых физических активностях, таких как ходьба и скалолазание в определенных горных районах, по которым есть обозначенные тропы. В зависимости от индивидуальных обстоятельств и сопутствующего состояния здоровья предусмотрены разные варианты маршрутов: от более коротких (до 500 м) до более длинных (до 3000 м). Захватывающий вид на горы и свежий воздух улучшают настроение пациенток, вызывают чувство спокойствия и способствуют расслаблению.
Укрепление мышц тазового дна
Значение укрепления мышц тазового дна в реабилитации женщин с онкогинекологическими заболеваниями невозможно переоценить. При слабости мышц тазового дна нормальное анатомическое положение внутренних половых органов нередко изменяется, что приводит к нарушениям их функционирования. Изометрические упражнения обычно используются для оптимизации функционального состояния этих мышц. Таким образом, укрепление тазовой диафрагмы становится решающим фактором в лечении различных патологических состояний в области таза.
В последнее время новый метод терапии с биологической обратной связью привлек значительное внимание. Этот подход предполагает постоянный мониторинг физиологических показателей, таких как активность тазового дна и мышц брюшины, в режиме реального времени. Пациенткам предоставляется возможность сознательно контролировать эти показатели с применением мультимедийных или игровых методик. Например, с помощью специализированной программы терапии биологической обратной связи пациентка может управлять полетом птицы на экране, напрягая и расслабляя мышцы тазового дна. Данный эффективный интерактивный метод помогает научиться активировать и тренировать эти мышцы. Визуальная обратная связь позволяет женщинам наблюдать и изменять сокращение своих мышц для достижения желаемых условий тренировки, постепенно укрепляя их с каждым занятием [62][63].
Физиотерапевтические методы
Большое значение в области реабилитации имеют хорошо зарекомендовавшие себя физиотерапевтические методы, к которым относят гипербарическую терапию, способствующую увеличению оксигенации, магнитотерапию, лимфодренажную терапию, электросон, дарсонвализацию и др. Они позволяют восстанавливать локальную микроциркуляцию, облегчать тазовые боли и отеки, уменьшать лимфедему, восстанавливать чувствительность и тонус мышечных волокон, а также укреплять связочную структуру [64][65].
Психотерапевтическая поддержка
Жизненно важную роль в комплексной реабилитации играет психотерапия, выступая важнейшим ее компонентом на протяжении всего периода лечения. Больные РШМ, в т.ч. находящиеся на реабилитации, нуждаются в психологической поддержке посредством групповой или индивидуальной психотерапии. Исследования подтвердили, что включение психотерапии в лечение и реабилитацию увеличивает выживаемость. Она не только улучшает психическое благополучие пациенток, но и положительно влияет на их КЖ, помогает устранить стрессовый фактор, воздействующий на объективные показатели здоровья, в частности восстановить нарушенный гормональный баланс.
Психореабилитация – отдельная область реабилитации, которая постоянно совершенствует свои подходы и методы оказания помощи онкологическим больным. Психотерапевты, психологи и сексологи сотрудничают в решении проблем измененного восприятия тела, социальной дезадаптации, сексуальной дисфункции, страха рецидива, смерти и боли, а также тревоги и апатии. Сеанс психотерапии следует начинать с разъяснения патогенеза, симптомов и методов лечения заболевания, чтобы развеять недоразумения и облегчить тревожность пациентки. Последующая коррекция предполагает решение психоэмоциональных проблем личности [66][67].
Санаторно-курортное лечение
Использование природных ресурсов, таких как минеральные воды, климат и ландшафтная терапия, является неотъемлемым компонентом курортного лечения, проводимого в рамках реабилитационных мероприятий. Синергетическое воздействие этих факторов окружающей среды как на физиологическое, так и на психологическое благополучие позволяет эффективно управлять КЖ. Лечебные прогулки, загорание, занятия аэротерапией, прогулки по тропам здоровья оказывают положительное влияние на физическое и эмоциональное состояние пациенток, перенесших лечение онкогинекологических заболеваний [52][68].
Социально-экономическая эффективность реабилитации пациенток с онкогинекологическими заболеваниями / Socio-economic efficiency of rehabilitation for oncogynecological patients
В исследовании, проведенном Е. Meixner et al. [69], отмечено, что боль и усталость, вызванные лечением, значительно влияют на вероятность возвращения на работу. Службы социальной поддержки и медицинский персонал, проводящий реабилитацию, играют важную роль в поддержке трудоспособности и желания вернуться на работу у больных гинекологическим раком. Онкогинекологические пациентки, проходящие реабилитацию с применением лечебной физической культуры, нутритивной поддержки, психологической и социальной помощи, продемонстрировали гораздо более высокие показатели восстановления своей трудоспособности по сравнению с больными, не проходившими реабилитацию [69].
Реабилитация после применения радикальных методов лечения рака яичников и пограничных опухолей яичников (ПОЯ) требует персонализированного и комплексного подхода. Важно не только устранить или снизить негативное влияние морфофункциональных нарушений, возникших в результате лечения, но и учитывать социально-экономические и психологические факторы, а также образ жизни пациентки. Для оптимизации периода восстановления крайне важно точно идентифицировать больных, которые подвергаются более высокому риску долгосрочного ухудшения состояния. Интересный анализ социально-экономических последствий лечения рака яичников был проведен M.I. Liang et al. в исследовании с участием 22 пациенток [70]. Среди них 41% женщин имели государственную медицинскую страховку, а 68% проходили лечение от рецидива рака яичников. Во время опроса пациентки сообщали о снижении производительности, трудностях с возвращением на работу и опасениях по поводу потери работы или медицинской страховки. Основные проблемы в поиске или сохранении работы включали физические и когнитивные ограничения, возникшие в результате агрессивного противоопухолевого лечения, а также зависимость от лиц, осуществляющих уход, особенно когда дело касалось транспорта [70].
Потенциальные стратегии по улучшению показателей возвращения трудоспособности и профессиональной деятельности больных гинекологическим раком должны включать предоставление медицинской страховки, изменение должностных обязанностей на работе и предоставление семейного отпуска по болезни. С точки зрения специалистов по лечению и проведению реабилитации крайне важно интегрировать плановое обследование с активностью на работе и обеспечить максимальное восстановление при непрерывности рабочей деятельности. Активное общение с работодателями также важно для успешной социализации больных после радикального лечения рака женской репродуктивной системы. Боль, усталость и депрессия являются частыми симптомами, с которыми сталкиваются пациентки с раком яичников и ПОЯ, негативно влияют на КЖ и повседневную деятельность. Исследователи постоянно подчеркивают важность работы в жизни людей, больных раком, поскольку она не только обеспечивает финансовую безопасность, но также способствует самоидентификации, самооценке, социальным отношениям и общему благополучию. Таким образом, среди пациенток после лечения онкогинекологических заболеваний существует высокая потребность в трудоустройстве, сохранении работы и социализации. Однако эту потребность часто трудно удовлетворить из-за физических и психологических ограничений, возникающих в результате противоопухолевой терапии.
К. Nakamura et al. [71] в клиническом исследовании с участием 97 женщин изучили влияние методов лечения РШМ в ранней стадии на возвращение пациенток к работе. Оценивали такие методы лечения, как радикальная гистерэктомия (n=29, группа РГ), одновременная химиолучевая/лучевая терапия (n=21, группа ХЛ) и комбинация радикальной гистерэктомии с одновременной химиолучевой/лучевой терапией (n=47, группа РГ+ХЛ). Далее анализировали социальный статус пациенток по наличию у них работы. В группе РГ работало 27 женщин, в группе ХЛ – 15, в группе РГ+ХЛ – 40. На момент исследования средний срок после проведения лечения составил 4,5 года. Было обнаружено, что более серьезное медицинское вмешательство соотносится с более высокой частотой прекращения трудовой деятельности. Так, из 27 женщин в группе РГ к работе вернулись 26, в группе ХЛ – 14 из 15, в группе РГ+ХЛ – 29 из 40. Таким образом, у пациенток из группы РГ+ХЛ частота возвращения на работу была значительно ниже в сравнении с группой РГ (p<0,05). При этом была выявлена достоверная связь между невозвращением на работу и лимфедемой нижних конечностей (p<0,05). Данное исследование указывает на необходимость персонифицированного подхода к реабилитации у женщин, проходящих лечение онкогинекологических заболеваний, особенно с помощью комплексных агрессивных методов [71]. Пациентки, прошедшие комплексную и активную реабилитацию, гораздо быстрее возвращаются к работе по сравнению с теми, кто прошел стандартные методы восстановления [72].
Текущее состояние организации реабилитации больных онкогинекологического профиля / Оrganization of rehabilitation for oncogynecological patients: сurrent state
Ведение онкогинекологических больных после противоопухолевого лечения затруднено из-за отсутствия общепризнанных подходов к организации реабилитации. В настоящее время не существует четко определенного общепринятого алгоритма маршрутизации больных после радикального хирургического лечения опухолей яичников.
Вопрос доступа к реабилитации остается в определенной степени нерешенным, поскольку не все больные имеют финансовые возможности для прохождения программ реабилитации. Социальное благополучие играет решающую роль в общем КЖ пациенток, охватывая различные аспекты, такие как семейные и личные отношения, а также профессиональное взаимодействие.
Комплексный онлайн-опрос, проведенный среди 21 806 женщин с диагнозом рака яичников, выявил острую потребность в социальной поддержке со стороны членов семьи, друзей, других пациенток, сталкивающихся с аналогичными проблемами, и медицинских работников. Кроме того, женщины заявили об отсутствии помощи в вопросах, связанных с трудоустройством, сохранением работы, юридическими проблемами инвалидности и поддержанием профессиональных отношений [73–75].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Агрессивное лечение онкогинекологических заболеваний пагубно влияет на общее самочувствие женщины, значительно снижая ее КЖ. Хирургические вмешательства и химиолучевая терапия могут привести к различным осложнениям, таким как постлучевые поражения, лимфедема, желудочно-кишечные расстройства, рецидивирующие инфекции, психологические и социальные проблемы, а также сексуальная дисфункция. Это особенно сложно для женщин молодого возраста, которые ценят и хотят реализовать способность стать матерями, сохранить свою привлекательность и социальную активность.
Ранее реабилитационную помощь сильно затрудняла закостенелость системы как на методическом, так и на административном уровне. Для решения данных проблем был разработан комплексный план лечения, состоящий из конкретных этапов и сроков, а также ранней психотерапевтической поддержки больных с целью вселить надежду и смягчить негативное воздействие на КЖ. Активная реабилитация и регулярные последующие обследования имеют решающее значение в ведении пациенток после лечения, обеспечивая наилучший результат. В последнее время в системе оказания реабилитационной помощи отмечен некоторый прогресс. Однако необходимо предпринимать более серьезные шаги для качественного улучшения оказания помощи женщинам с онкогинекологическими заболеваниями.
Список литературы
1. Soerjomataram I., Bray F. Planning for tomorrow: global cancer incidence and the role of prevention 2020–2070. Nat Rev Clin Oncol. 2021; 18 (10): 663–72. https://doi.org/10.1038/s41571-021-00514-z.
2. Sung H., Ferlay J., Siegel R.L., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021; 71 (3): 209–49. https://doi.org/10.3322/caac.21660.
3. Шахзадова А.О., Старинский В.В., Лисичникова И.В. Состояние онкологической помощи населению России в 2022 году. Сибирский онкологический журнал. 2023; 22 (5): 5–13. https://doi.org/10.21294/1814-4861-2023-22-5-5-13.
4. Заболеваемость раком шейки матки, на 100 000 населения. Всемирная организация здравоохранения. Европейский портал информации здравоохранения. URL: https://gateway.euro.who.int/ru/indicators/hfa_377-2360-incidence-of-cervix-uteri-cancerper-100-000/ (дата обращения 03.12.2023).
5. Блинов Д.В., Солопова А.Г., Плутницкий А.Н. и др. Организация здравоохранения в сфере реабилитации пациенток с онкологическими заболеваниями репродуктивной системы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022; 15 (1): 119–30. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.132.
6. Приказ Департамента здравоохранения города Москвы от 11.09.2020 № 1032 «О диспансерном наблюдении за взрослыми со злокачественными новообразованиями и пациентами с заболеваниями из групп риска по развитию злокачественных новообразований». URL: https://docs.cntd.ru/document/603188178 (дата обращения 16.12.2023).
7. Приказ Департамента здравоохранения города Москвы от 14.01.2022 № 16 «Об организации оказания медицинской помощи по профилю «онкология» в медицинских организациях государственной системы здравоохранения города Москвы». URL: https://docs.cntd.ru/document/728352117 (дата обращения 16.12.2023).
8. Рак шейки матки. Клинические рекомендации. 2020. URL: https://cr.minzdrav.gov.ru/recomend/537_1 (дата обращения 16.12.2023).
9. Bhatla N., Berek J.S., Cuello Fredes M., et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynaecol Obstet. 2019; 145 (1): 129–35. https://doi.org/10.1002/ijgo.12749.
10. Goldstraw P., Chansky K., Crowley J., et al. The IASLC Lung Cancer Staging Project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol. 2016; 11 (1): 39–51. https://doi.org/10.1016/j.jtho.2015.09.009.
11. Чернышова А.Л., Коломиец Л.А., Красильников С.Э. Органосохраняющее лечение при инвазивном раке шейки матки. Сибирский онкологический журнал. 2011; 2: 72–8.
12. Балахонцева О.С., Новикова О.В., Антипов В.А. Гормонотерапия сопровождения при освоении методики радикальной абдоминальной трахелэктомии. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2009; 20 (2): 60.
13. Тумунов Ч.Б., Бадмажапов А.В., Насанов Н.Б., Каюкова Е.В. Оценка эффективности использования радикальной трахелэктомии в лечении рака шейки матки. В кн.: Медицина завтрашнего дня. Материалы XVI межрегиональной научно-практической конференции студентов и молодых ученых: сборник научных трудов. Чита: Читинская государственная медицинская академия; 2017: 170–1.
14. Кайрбаев М.Р., Кайрбаева М.Ж., Сериков С.М., Сарсенова А.Б. Отдаленные результаты радикальной трахелэктомии при инвазивном раке шейки матки у женщин фертильного возраста. Онкология и радиология Казахстана. 2019; S: 74–5.
15. Оводенко Д.Л., Хабас Г.Н., Макарова А.С. и др. Лапароскопическая радикальная гистерэктомия при раке шейки матки стадий Ia2–IIb. Акушерство и гинекология. 2018; 4: 101–7. https://doi.org/10.18565/aig.2018.4.101-107.
16. Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol. 2008; 26 (35): 5802–12. https://doi.org/10.1200/JCO.2008.16.4368.
17. Оводенко Д.Л., Хабас Г.Н., Макарова А.С. и др. Современные методы лечения больных местнораспространенным раком шейки матки. Акушерство и гинекология: новости, мнения, обучение. 2019; 7 (1): 68–74.
18. Okunade K.S. Human papillomavirus and cervical cancer. J Obstet Gynaecol. 2020; 40 (5): 602–8. https://doi.org/10.1080/01443615.2019.1634030.
19. Xu Q., Wang J., Sun Y., et al. Efficacy and safety of sintilimab plus anlotinib for PD-L1-positive recurrent or metastatic cervical cancer: a multicenter, single-arm, prospective phase II trial. J Clin Oncol. 2022; 40 (16): 1795–805. https://doi.org/10.1200/JCO.21.02091.
20. Shibata T., Lieblong B.J., Sasagawa T., Nakagawa M. The promise of combining cancer vaccine and checkpoint blockade for treating HPV-related cancer. Cancer Treat Rev. 2019; 78: 8–16. https://doi.org/10.1016/j.ctrv.2019.07.001.
21. Silva A.J.D., de Moura I.A., da Gama M.A.T.M., et al. Advancing immunotherapies for HPV-related cancers: exploring novel vaccine strategies and the influence of tumor microenvironment. Vaccines. 2023; 11 (8): 1354. https://doi.org/10.3390/vaccines11081354.
22. Bonneville R., Krook M.A., Kautto E.A., et al. Landscape of microsatellite instability across 39 cancer types. JCO Precis Oncol. 2017; 2017: PO.17.00073. https://doi.org/10.1200/PO.17.00073.
23. Tewari K.S., Sill M.W., Penson R.T., et al. Bevacizumab for advanced cervical cancer: final overall survival and adverse event analysis of a randomised, controlled, open-label, phase 3 trial (Gynecologic Oncology Group 240). Lancet. 2017; 390 (10103): 1654–63. https://doi.org/10.1016/S0140-6736(17)31607-0.
24. Чуруксаева О.Н., Коломиец Л.А. Проблемы качества жизни онкогинекологических больных. Вопросы oнкологии. 2017; 63 (3): 368–74.
25. Солопова А.Г., Идрисова Л.Э., Макацария А.Д. и др. Мультидисциплинарный подход к медицинской реабилитации онкогинекологических больных. Акушерство, гинекология и репродукция. 2017; 11 (4): 57–67. https://doi.org/10.17749/2313-7347.2017.11.4.057-067.
26. Молчанов С.В., Коломиец Л.А., Гриднева Т.Д. Роль реабилитации в повышении качества жизни онкогинекологических больных репродуктивного возраста после противоопухолевого лечения. Сибирский онкологический журнал. 2012; 3: 46–9.
27. Hu H., Fu M., Huang X., et al. Risk factors for lower extremity lymphedema after cervical cancer treatment: a systematic review and meta-analysis. Transl Cancer Res. 2022; 11 (6): 1713–21. https://doi.org/10.21037/tcr-22-1256.
28. Корытов О.В. Влияние поздних лучевых осложнений на качество жизни и отдаленную выживаемость пациентов, получавших облучение органов малого таза. Российский биотерапевтический журнал. 2022; 21 (2): 67–72. https://doi.org/10.17650/1726-9784-2022-21-2-67-72.
29. Столярова И.В., Винокуров Л.В. Проблемы больных после лечения рака шейки матки (профилактика и лечение постлучевых осложнений). Практическая oнкология. 2002; 3 (3): 220–7.
30. Сычева И.В., Каприн А.Д., Иванов С.А. Сочетание поздних лучевых повреждений органов малого таза у больной после химиолучевого лечения рака шейки матки IIB ст. cT2bN0M0 и их лечение (клинический пример). Вопросы oнкологии. 2022; 68 (1): 99–105. https://doi.org/10.37469/0507-3758-2022-68-1-99-105.
31. Mishra N., Singh N., Sachdeva M., Ghatage P. Sexual dysfunction in cervical cancer survivors: a scoping review. Womens Health Rep. 2021; 2 (1): 594–607. https://doi.org/10.1089/whr.2021.0035.
32. Tramacere F., Lancellotta V., Casà C., et al. Assessment of sexual dysfunction in cervical cancer patients after different treatment modality: a systematic review. Medicina. 2022; 58 (9): 1223. https://doi.org/10.3390/medicina58091223.
33. Greimel E.R., Kuljanic Vlasic K., Waldenstrom A.C., et al. The European Organization for Research and Treatment of Cancer (EORTC) Quality-of-Life questionnaire cervical cancer module: EORTC QLQ-CX24. Cancer. 2006; 107 (8): 1812–22. https://doi.org/10.1002/cncr.22217.
34. Kyei K.A., Yakanu F., Donkor A., et al. Quality of life among cervical cancer patients undergoing radiotherapy. Pan Afr Med J. 2020; 35: 125. https://doi.org/10.11604/pamj.2020.35.125.18245.
35. Corrêa C.S.L., Leite I.C.G., Andrade A.P.S., et al. Sexual function of women surviving cervical cancer. Arch Gynecol Obstet. 2016; 293 (5): 1053–63. https://doi.org/10.1007/s00404-015-3857-0.
36. Hanprasertpong J., Geater A., Jiamset I., et al. Fear of cancer recurrence and its predictors among cervical cancer survivors. J Gynecol Oncol. 2017; 28 (6): e72. https://doi.org/10.3802/jgo.2017.28.e72.
37. Блбулян Т.А., Солопова А.Г., Иванов А.Е., Куркина Е.И. Влияние послеоперационной реабилитации на качество жизни больных раком вульвы. Акушерство, гинекология и репродукция. 2020; 14 (4): 415–25. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.156.
38. Liu Z., Shi H. Prognostic Role of squamous cell carcinoma antigen in cervical cancer: a meta-analysis. Disease Markers. 2019; 2019 (1): 6710352. https://doi.org/10.1155/2019/6710352.
39. Park S.Y., Bae D.S., Nam J.H., et al. Quality of life and sexual problems in disease-free survivors of cervical cancer compared with the general population. Cancer. 2007; 110 (12): 2716–25. https://doi.org/10.1002/cncr.23094.
40. Хохлова С.В., Коломиец Л.А., Кравец О.А. и др. Практические рекомендации по лекарственному лечению рака шейки матки. Злокачественные oпухоли. 2021; 11 (3S2-1): 197–217. https://doi.org/10.18027/2224-5057-2021-11-3s2-13.
41. Аксель Е.М., Виноградова Н.Н. Статистика злокачественных новообразований женских репродуктивных органов. Онкогинекология. 2018; 3: 64–78. https://doi.org/10.52313/2227871 0_2018_3_64.
42. Приказ Министерства труда и социальной защиты РФ от 03.09.2018 № 572н «Об утверждении профессионального стандарта «Специалист по медицинской реабилитации». URL: https://docs.cntd.ru/document/551160092 (дата обращения 16.12.2023).
43. Национальная стратегия по борьбе с онкозаболеваниями на долгосрочный период до 2030 года. URL: https://www.nop2030.ru/dokumenty/natsionalnaya-strategiya-po-borbe-sonkozabolevaniyami-na-dolgosrochnyj-period-do-2030-goda/ (дата обращения 16.12.2023).
44. Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://www.consultant.ru/document/cons_doc_LAW_121895/ (дата обращения 16.12.2023).
45. Приказ Минздрава России от 29.12.2012 № 1705н «О порядке организации медицинской реабилитации». URL: https://www.consultant.ru/document/cons_doc_LAW_143130/ (дата обращения 16.12.2023).
46. Приказ Минздрава России от 23.10.2019 № 878н «Об утверждении порядка организации медицинской реабилитации детей». URL: https://normativ.kontur.ru/document?moduleId=1&documentId=351596&cwi=2170 (дата обращения 16.12.2023).
47. Приказ Минздрава России от 31.07.2020 № 788н «Об утверждении порядка организации медицинской реабилитации взрослых». URL: https://normativ.kontur.ru/document?moduleId=1&documentId=438476 (дата обращения 16.12.2023).
48. Реестр реабилитационных центров России. Благотворительный фонд «Правмир». URL: https://fondpravmir.ru/reestr/ (дата обращения 17.12.2023).
49. Weis J., Giesler J.M. Rehabilitation for cancer patients. Recent Results Cancer Res. 2018; 210: 105–22. https://doi.org/10.1007/978-3-319-64310-6_7.
50. Бегович Ё., Солопова А.Г., Хлопкова С.В. и др. Возможности и перспективы эпигенетической реабилитации у пациенток с наружной формой генитального эндометриоза. Врач. 2022; 33 (5): 5–8. https://doi.org/10.29296/25877305-2022-05-01.
51. Власина А.Ю., Солопова А.Г., Иванова Е.А., Блбулян Т.А. «Противораковая диета», или принципы рационального питания онкогинекологических больных в период реабилитации. Врач. 2020; 31 (4): 3–7. https://doi.org/10.29296/25877305-2020-04-01.
52. Хасанов Р.Ш., Озол С.А., Гилязутдинов И.А. и др. Современные принципы реабилитации онкологических больных (обзор литературы). Поволжский онкологический вестник. 2013; 4: 49–55.
53. Ryan R.F., Shambaugh E.M. Human anatomy as related to tumor formation. U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health; 2001.
54. Iżycki D., Woźniak K., Iżycka N. Consequences of gynecological cancer in patients and their partners from the sexual and psychological perspective. Prz Menopauzalny. 2016; 15 (2): 112–6. https://doi.org/10.5114/pm.2016.61194.
55. Marin F., Pleşca M., Bordea C., et al. Postoperative surgical complications of lymphadenohysterocolpectomy. J Med Life. 2014; 7 (1): 60–6.
56. Ткаченко Г.А., Степанова А.М. Психологическая реабилитация онкологических больных: от истоков к современности. Злокачественные опухоли. 2022; 12 (4): 36–40. https://doi.org/10.18027/2224-5057-2022-12-4-36-40.
57. Идрисова Л.Э., Солопова А.Г., Табакман Ю.Ю. и др. Основные направления психологической реабилитации онкогинекологических больных. Акушерство, гинекология и репродукция. 2017; 10 (4): 94–104. https://doi.org/10.17749/2313-7347.2016.10.4.094-104.
58. Mukherjee O., Rakshit S., Shanmugam G., Sarkar K. Role of chemo therapeutic drugs in immunomodulation of cancer. Curr Res Immunol. 2023; 4: 100068. https://doi.org/10.1016/j.crimmu.2023.100068.
59. Moreno-Smith M., Lutgendorf S.K., Sood A.K. Impact of stress on cancer metastasis. Future Oncol. 2010; 6 (12): 1863–81. https://doi.org/10.2217/fon.10.142.
60. Бухтояров О.В., Самарин Д.М. Обоснование необходимости проведения противорецидивной реабилитации больных злокачественными опухолями с психогенным анамнезом. Вестник восстановительной медицины. 2016; 5: 32–6.
61. Баллюзек М.Ф., Ионова А.К., Машкова М.В. и др. Организация программ реабилитации онкологических пациентов на основе междисциплинарного подхода. Research’n Practical Medicine Journal. 2018; 5 (4): 91–7. https://doi.org/10.17709/2409-2231-2018-5-4-9.
62. Li X., Liu L., He J., et al. Analysis of the effectiveness of the application of pelvic floor rehabilitation exercise and the factors influencing its self-efficacy in postoperative patients with cervical cancer. Front Oncol. 2023; 13: 1118794. https://doi.org/10.3389/fonc.2023.1118794.
63. Li H., Zhou C.K., Song J., et al. Curative efficacy of low frequency electrical stimulation in preventing urinary retention after cervical cancer operation. World J Surg Oncol. 2019; 17: 141. https://doi.org/10.1186/s12957-019-1689-2.
64. Cullen K., Fergus K., DasGupta T., et al. Toward clinical care guidelines for supporting rehabilitative vaginal dilator use with women recovering from cervical cancer. Support Care Cancer. 2013; 21 (7): 1911–7. https://doi.org/10.1007/s00520-013-1726-6.
65. Monteiro M.G.C.T., de Morais Gouveia G.P. Physiotherapy in the management of gynecological cancer patient: a systematic review. J Bodyw Mov Ther. 2021; 28: 354–61. https://doi.org/10.1016/j.jbmt.2021.06.027.
66. Grassi L., Spiegel D., Riba M. Advancing psychosocial care in cancer patients. F1000Res. 2017; 6: 2083. https://doi.org/10.12688/f1000research.11902.1.
67. Wang Y., Feng W. Cancer-related psychosocial challenges. Gen Psychiatr. 2022; 35 (5): e100871. https://doi.org/10.1136/gpsych-2022-100871.
68. Естенкова М.Г., Елизаров А.Н. К вопросу санаторно-курортного лечения больных, имеющих онкологические заболевания. Физиотерапия, бальнеология и реабилитация. 2013; 6: 54–5.
69. Meixner E., Sandrini E., Hoeltgen L., et al. Return to work, fatigue and cancer rehabilitation after curative radiotherapy and radiochemotherapy for pelvic gynecologic cancer. Cancers. 2022; 14 (9): 2330. https://doi.org/10.3390/cancers14092330.
70. Liang M.I., Simons J.L., Herbey I.I., et al. Navigating job and cancer demands during treatment: a qualitative study of ovarian cancer patients. Gynecol Oncol. 2022; 166 (3): 481–6. https://doi.org/10.1016/j.ygyno.2022.07.021.
71. Nakamura K., Masuyama H., Ida N., et al. Radical hysterectomy plus concurrent chemoradiation/radiation therapy is negatively associated with return to work in patients with cervical cancer. Int J Gynecol Cancer. 2017; 27: 117–22. https://doi.org/10.1097/igc.0000000000000840.
72. Wu X., Liu Y., Zhu D., et al. Early prevention of complex decongestive therapy and rehabilitation exercise for prevention of lower extremity lymphedema after operation of gynecologic cancer. Asian J Surg. 2021; 44 (1): 111–5. https://doi.org/10.1016/j.asjsur.2020.03.022.
73. Ferrell B.R., Smith S.L., Ervin K.S., et al. A qualitative analysis of social concerns of women with ovarian cancer. Psychooncology. 2003; 12 (7): 647–63. https://doi.org/10.1002/pon.681.
74. Власина А.Ю., Идрисова Л.Э., Солопова А.Г. и др. Реабилитация онкогинекологических больных после противоопухолевой терапии: пути решения. Акушерство, гинекология и репродукция. 2020; 14 (1): 44–55. https://doi.org/10.17749/2313-7347.2020.14.1.44-55.
75. Zhang C., Sheng Y., Sun X., Wang Y. New insights for gynecological cancer therapies: from molecular mechanisms and clinical evidence to future directions. Cancer Metastasis Rev. 2023; 42 (3): 891–925. https://doi.org/10.1007/s10555-023-10113-2.
Об авторе
С. А. АкавоваРоссия
Акавова Саида Абдулкадыровна
Загородное ш., д. 18А, стр. 7, Москва 117152
Рецензия
Для цитирования:
Акавова С.А. Маршрутизация пациенток при реабилитации после лечения онкогинекологических патологий. Реабилитология. 2024;2(1):158-172. https://doi.org/10.17749/2949-5873/rehabil.2024.21
For citation:
Akavova S.A. Patient routing system in rehabilitation after treatment for oncogynecological pathologies. Journal of Medical Rehabilitation. 2024;2(1):158-172. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2024.21






