Перейти к:
Роль эпигенетики в вопросах диагностики, лечения и реабилитации пациентов со злокачественными новообразованиями
https://doi.org/10.17749/2949-5873/rehabil.2023.2
Аннотация
Актуальность. Эпигенетика является разделом генетики, изучающим влияние внешних факторов на экспрессию генов. Многочисленные исследования показали существенную роль эпигенетических механизмов в регуляции экспрессии генов, в т.ч. у пациентов со злокачественными новообразованиями (ЗНО). Несмотря на очевидную перспективность использования принципов и инструментов эпигенетики в диагностике, лечении и восстановлении пациентов, внедрение этой новой технологии остается на сравнительно низком уровне.
Цель: определить значимость эпигенетических механизмов в диагностике, прогнозировании исхода и реабилитации пациентов с онкологическими заболеваниями.
Материал и методы. Поиск публикаций выполняли в научных базах данных и электронных библиотеках: PubMed/ MEDLINE, ScienceDirect, Google Schoolar, eLibrary. В обзор вошло 79 статей, посвященных роли эпигенетических механизмов в диагностике, лечении и реабилитации пациентов с ЗНО.
Результаты. Среди наиболее изученных эпигенетических изменений (ЭГИ) у пациентов онкологического профиля выделяют метилирование ДНК, ковалентные модификации гистонов, регуляцию микроРНК. Представлен альтернативный подход к определению эпигенетических маркеров – жидкостная биопсия. Также определены биомаркеры, позволяющие диагностировать и прогнозировать течение онкологических заболеваний, в частности рака легких, рака молочной железы. Ряд ЭГИ соотносится с проведением реабилитационных мероприятий, таких как оказание нутритивной поддержки, физическая нагрузка, поддержание циркадных ритмов и иглоукалывание.
Заключение. Проведенный анализ публикаций подтвердил существенную значимость ЭГИ в развитии ЗНО. Полученные результаты указали на достаточное количество исследований, посвященных поиску новых средств диагностики и прогнозированию исхода онкологических заболеваний с помощью биомаркеров ЭГИ. Однако отмечено сравнительно малое число исследований по механизмам ЭГИ в процессе реабилитации. Дальнейшее изучение особенностей эпигенетических механизмов изменчивости позволит существенно продвинуться в разработке таргетных препаратов и персонифицированной реабилитации пациентов с ЗНО.
Ключевые слова
Для цитирования:
Власина А.Ю., Бегович Ё. Роль эпигенетики в вопросах диагностики, лечения и реабилитации пациентов со злокачественными новообразованиями. Реабилитология. 2023;1(1):69-79. https://doi.org/10.17749/2949-5873/rehabil.2023.2
For citation:
Vlasina A.Yu., Begovich E. The role of epigenetics in the diagnosis, treatment and rehabilitation of patients with malignant neoplasms. Journal of Medical Rehabilitation. 2023;1(1):69-79. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2023.2
ВВЕДЕНИЕ / INTRODUCTION
В современном научном сообществе под эпигенетикой подразумевают раздел генетики, посвященный изучению влияния образа жизни человека и факторов окружающей среды на закономерности экспрессии генов [1][2]. Эпигенетические изменения (ЭГИ) носят динамический, обратимый характер, наследуются соматически и влияют на экспрессию генов, не меняя их последовательность. Они могут усиливать либо подавлять экспрессию генов посредством различных механизмов, таких как метилирование ДНК, модификация гистонов и воздействие некодирующей микроРНК на матричную РНК (мРНК) [1–4].
Нарушение наследуемости эпигенетических «меток» может привести к неадекватной инициации или ингибированию экспрессии генов, что в конечном счете вызовет патологические изменения, включая запуск онкологических процессов [2][5]. Усиление онкогенеза в организме является следствием накопленных генетических мутаций и ЭГИ. В многочисленных исследованиях охарактеризовано влияние генетической составляющей на течение онкологических заболеваний, начиная от сигнальных путей, регулируемых онкогенами, и заканчивая спектром мутаций в различных подтипах злокачественных новообразований (ЗНО). В отличие от результатов данных исследований роли генетических мутаций в формировании ЗНО, ЭГИ изменяют экспрессию генов без необратимых изменений в геномной последовательности у пациентов с онкологическими заболеваниями [1][6].
Cчиталось, что разработки в области секвенирования генома человека позволят существенно продвинуться в формировании персонифицированных подходов к лечению и реабилитации, адаптированных к уникальному генотипу каждого пациента [7][8]. Однако стало ясно, что, хотя ДНК людей схожи на 99,9%, их индивидуальные физиологические различия существенны. Они в целом связаны с влиянием опыта, окружающих факторов и образа жизни человека на биологическую активность генома. Следовательно, эпигенетика может стать ключом к прогнозированию ответа пациента на конкретные лечебные и восстановительные меры, а также позволит определить терапевтические и реабилитационные мишени [4][6–8].
Показано, что ЭГИ затрагивают не только раковые клетки, но и микроокружение опухоли, которое играет крайне важную роль в питании и развитии ЗНО, взаимодействии опухоли с окружающими тканями, метастазировании, «ускользании» от иммунной системы человека [1][2][4]. Таким образом, управление эпигенетическими регуляторными механизмами ЗНО может способствовать развитию персонифицированной терапии и реабилитации.
Цель – определить значимость эпигенетических механизмов в диагностике, прогнозировании исхода и реабилитации пациентов с онкологическими заболеваниями.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Поиск публикаций проводили в научных базах данных и электронных библиотеках: PubMed/MEDLINE, ScienceDirect, Google Schoolar, eLibrary. Глубина поиска в указанных агрегаторах составила 20 лет. Также принимали во внимание результаты отбора в поисковых системах Яндекс (Россия) и Google (США). В анализ были взяты исследования на русском и английском языках.
На первом этапе идентифицировали работы по сочетаниям поисковых запросов «эпигенетика», «эпигенетические модификации», «механизм», «рак», «онкология», “epigenetics”, “epigenetic modifications”, “mechanism”, “cancer”, “oncology”. Затем среди обнаруженных исследований отбирали те, которые были связаны с диагностикой, лечением и реабилитацией пациентов с ЗНО по запросам «диагностика», «лечение», «реабилитация», “diagnosis”, “treatment”, “rehabilitation”.
На втором этапе исключали дублирующие публикации. Третий этап состоял в отборе работ, к которым был получен открытый доступ. На четвертом этапе были отобраны статьи, полученные из официальных и рецензируемых источников и соответствующие теме обзора.
Отбор публикаций из поисковых систем (Яндекс, Google) был проведен вручную каждым автором индивидуально, результаты поиска суммировали, исключая дублирующие источники. При возникновении спорных ситуаций решение выносили совместно.
Отбор исследований / Selection of publications
В научных базах данных и электронных библиотеках было найдено 5179 статей. Ручной поиск выявил 35 публикаций. Итого было обнаружено 5214 источников.
Далее среди полученного списка проводили поиск публикаций, посвященных диагностике, лечению и реабилитации пациентов с ЗНО. Тем самым до этапа скрининга дошло 569 статей. Проверка дублирующих исследований выявила 64 схожие публикации. Среди оставшихся 505 исследований выполняли поиск полнотекстовых статей. Из выявленных работ только к 423 был получен полный доступ.
На последнем этапе проводили отбор публикаций из рецензируемых журналов, а также не вызывающих сомнение источников, текст которых был посвящен интересующей нас тематике. Итого в обзор литературы вошло 79 источников.
Схема отбора публикаций представлена на рисунке 1.
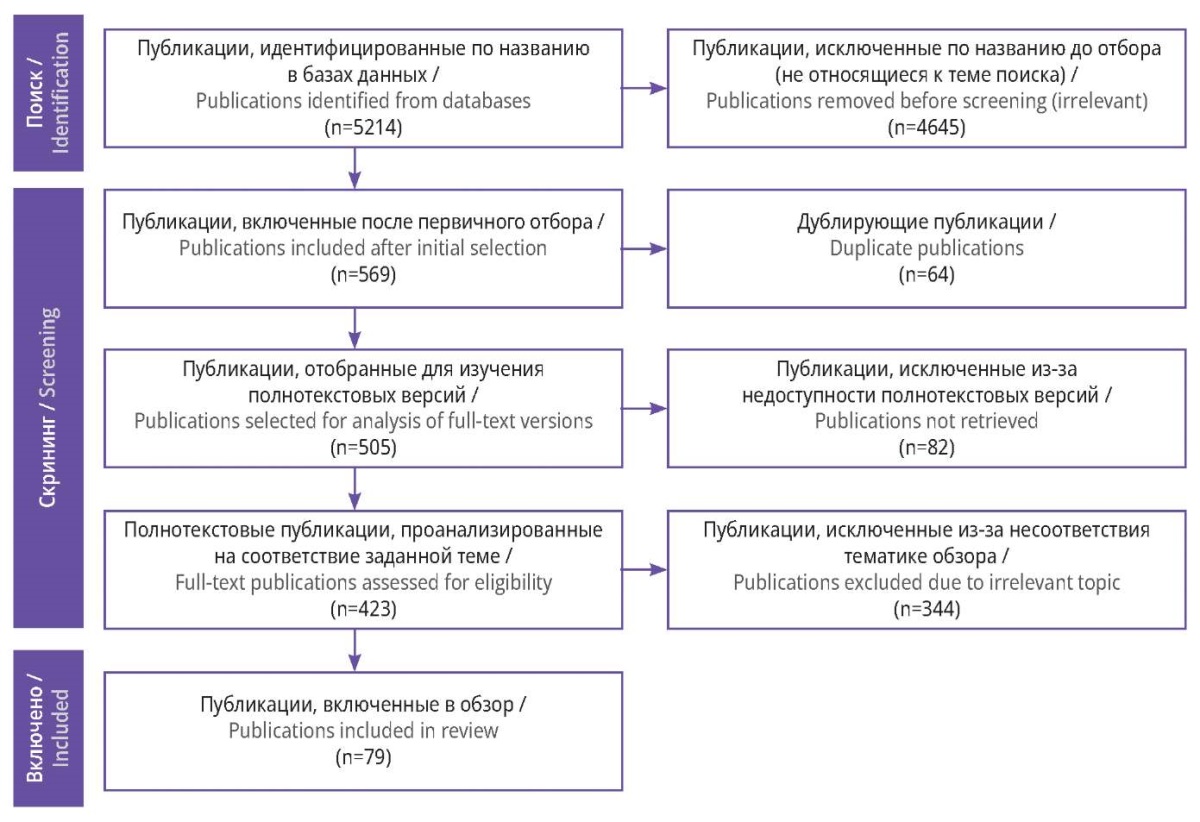
Рисунок 1. Блок-схема отбора публикаций с учетом рекомендаций PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses)
workflow for selection of publications
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Эпигенетические механизмы / Epigenetic mechanisms
Метилирование ДНК
Метилирование ДНК является часто встречаемым видом ЭГИ. В основе данного механизма лежат изменения в CpG-островках ДНК (кластеры нуклеотидов, где С – цитозин, G – гуанин, р – фосфодиэфирная связь, соединяющая два нуклеотида. Эти CpG-динуклеотиды расположены преимущественно в 5’-промоторных областях, где более 50% структурных генов, и таким образом могут влиять на экспрессию [9][10].
Как правило, ковалентное присоединение метильных групп S-аденозилметионина к промоторам приводит к тому, что факторы транскрипции не способны связаться с модифицированным промотором, тем самым ингибируя экспрессию гена. ЗНО характеризуются глобальным гипометилированием ДНК и локальным гиперметилированием определенных генов, в особенности генов – супрессоров опухолей или микроРНК, «замалчивание» которых способствует росту опухоли. Гипометилирование происходит главным образом в повторяющихся областях генома, что является причиной повреждения ДНК и запуска онкологических процессов [11–13].
Некоторые ДНК-метилтрансферазы (англ. DNA methyltransferases, DNMT), а именно DNMT1, DNMT3a и DNMT3b, катализируют метилирование ДНК. DNMT1, поддерживающая ДНК-метилтрансфераза, обладает более высокой каталитической активностью в отношении преимущественного метилирования полуметилированной ДНК во время репликации и в основном отвечает за поддержание статуса метилирования ДНК. Точные закономерности метилирования ДНК, обнаруженные в геноме млекопитающих, генерируются и наследственно поддерживаются совместной активностью DNMT3A и DNMT3B. Данные метилтрансферазы действуют независимо от репликации и одинаково взаимодействуют как с неметилированной, так и с полуметилированной ДНК [13][14].
Деметилирование ДНК − это обратный процесс, который восстанавливает экспрессию генов. Такие изменения катализируются семейством транслокационных метилцитозиндиоксигеназ Ten-eleven (например, TET1, TET2 и TET3), которые могут превращать 5-метилцитозин в 5-гидроксиметилцитозин (5-hmC), а также дополнительно окислять 5-hmC в 5-формилцитозин и 5-карбоксилцитозин [15]. Гомеостаз между деметилированием и метилированием генома возникает как динамический механизм экспрессии генов в различных типах клеток.
Если роль метилирования промотора CpG-островков в дезактивации генов хорошо описана, то о значении метилирования ДНК в регуляции промоторов не-CpG-островков известно гораздо меньше. Например, тканеспецифичная экспрессия гена MASPIN, который не содержит CpG-островка внутри своего промотора, регулируется метилированием ДНК [2][16]. MASPIN – ингибитор сериновой протеазы с противоопухолевой активностью, способный подавлять рост и метастазирование опухоли in vivo, а также подвижность и инвазию злокачественных клеток in vitro.
G. Sharma et al. [16] изучали метилирование промотора MASPINв опухоли и в сыворотке крови у 100 пациенток с инвазивной карциномой молочной железы. По данным иммуногистохимии, гиперметилирование промотора коррелировало с экспрессией кодируемого белка в опухолях. Была обнаружена значительная связь между гиперметилированием промотора MASPINи потерей экспрессии его белка (p=0,01, отношение шансов 3,1; 95% доверительный интервал 1,3–7,4). В опухолях с высокой экспрессией MASPIN отмечали экспрессию изоформы A фактора роста эндотелия сосудов (англ. vascular endothelial growth factor A, VEGF-A) и ассоциированного с метастазами белка (англ. metastasis-associated protein 1, MTA1) выше, чем в ЗНО, которые утратили способность экспрессировать MASPIN. Эти результаты показывают, что аберрантное метилирование промотора связано с потерей иммунореактивности MASPIN в тканях рака молочной железы. К тому же потеря экспрессии MASPIN значимо коррелирует с повышенной экспрессией VEGF-A и MTA1 [16].
К схожим выводам о существенном влиянии метилирования промоторов не-CpG-островков пришли N. Hattori et al. В своем исследовании они показали сравнимые результаты, выбрав в качестве объекта исследования промотор Oct-4 (англ. octamer binding transcription factor 4), экспрессия которого связана с фенотипом недифференцированных клеток и опухолей [17].
Ковалентные модификации гистонов
Известно, что ДНК организована в нуклеосомы. Каждая нуклеосома состоит из ДНК, обернутой вокруг белков – гистонов [18]. Гистоны расположены в нуклеосомах так, что часть аминокислот (гистоновые хвосты) остаются открытыми. Именно эти структурные элементы играют ключевую роль в реализации механизмов ЭГИ. Аминокислоты, расположенные в хвосте гистонов, являются мишенями для ферментов, которые присоединяют или удаляют химические структуры. В частности, аминокислоты лизин и серин являются общими объектами модификации [18][19].
По сравнению с метилированием ДНК, модификация гистонов представляет собой относительно сложный процесс. На данный момент известно о восьми типах модификации гистонов: метилирование, ацетилирование, фосфорилирование, убиквитинилирование, аденозиндифосфат-рибозилирование, сумоилирование (от англ. small ubiquitin-like modifier, SUMO), дезаминирование и модификация через изомеризацию пролина [20]. Среди всех перечисленных типов относительно изученными являются следующие модификации:
- фосфорилирование гистонов – добавление фосфатных групп каминокислотам в белках-гистонах (зачастую фосфорилирование аминокислот в гистонах происходит по серину, треонину и тирозину с помощью протеинкиназ, а обратный процесс происходит под действием протеинфосфатаз);
- метилирование гистонов – присоединение метильной группы каминокислотам в белках-гистонах (часто модификации подвержены лизин и аргинин в гистоновых хвостах, процесс присоединения и отщепления метильных групп происходит с помощью гистоновых метилтрансфераз и гистоновых деметилаз соответственно);
- ацетилирование гистонов – присоединение ацетильной группы каминокислоте лизину (модификация проходит с помощью фермента ацетилтрансфераза гистонов и приводит к тому, что гистон становится менее положительно заряженным и притяжение между гистоном и связанной с ним ДНК ослабляется [19][21]; деацетилирование осуществляется с помощью деацетилазы гистонов (англ. histone deacetylases, HDAC), способствующей конденсации хроматина).
Небольшие изменения, описанные выше, изменяют форму нуклеосом и меняют способ взаимодействия ДНК с гистоном. Упомянутые модификации гистонов до сих пор остаются предметом пристального изучения. Появление неконтролируемой модификации гистонов может повлечь за собой патологические изменения экспрессии генов. Модификационные изменения гистонов способны подавлять экспрессию генов – супрессоров опухолей и усиливать экспрессию генов, влияющих на эффективность применяемой терапии. Так, у пациентов с ЗНО яичников показана корреляция между увеличением концентрации HDAC 4-го типа и снижением эффективности препаратов платины, используемых в терапии заболевания [22].
Регуляция микроРНК
Последовательности ДНК транскрибируются с образованием кодирующей (мРНК) или некодирующей РНК [23]. В то время как кодирующие РНК создают белки, некодирующие РНК контролируют экспрессию генов с помощью различных механизмов. МикроРНК представляют собой тип некодирующей РНК, которая связывается с 3’-концом нетранслируемой области (англ. untranslated region, UTR) мРНК, ингибируя трансляцию и последующий синтез белка с этой молекулой либо приводя к гибели данной РНК. МикроРНК участвуют в регуляции широкого спектра биологических процессов, включая пролиферацию, апоптоз и дифференцировку клеток. Кроме того, микроРНК модулируют эпигенетические регуляторные механизмы внутри клетки, воздействуя на ферменты, ответственные за метилирование ДНК (DNMT3A и DNMT3B) и модификацию гистонов (EZH2) [24][25].
МикроРНК могут функционировать либо как супрессоры опухолей, либо как онкогены в зависимости от их генов-мишеней. Дисрегуляция микроРНК является причиной развития ЗНО [26]. Так, уровень микроРНК-15/16, регулирующей экспрессию BCL2 (антиапоптотический ген), снижается при хроническом лимфоцитарном лейкозе, тогда как концентрация Let-7, регулирующей онкоген RAS в опухолевых клетках, снижается у пациентов с раком легких [27][28]. При опухолях простаты и мочевого пузыря снижается экспрессия микроРНК-127, отвечающей за BCL6, а при переходно-клеточной карциноме мочевого пузыря снижается уровень микроРНК-101 [25][29]. В свою очередь, при ЗНО наблюдается существенное усиление экспрессии онкогенных микроРНК. Так, отмечено значительное увеличение концентрации микроРНК-21 в опухолевых клетках при глиобластоме и микроРНК-155 при ЗНО молочной железы, легких и некоторых гемопоэтических опухолях [30][31].
Изменения экспрессии микроРНК могут быть связаны с хромосомными аномалиями, факторами транскрипции, эпигенетическими трансформациями и иными механизмами, что может являться точкой приложения для поиска новых средств терапии. Y. Saito et al. успешно продемонстрировали активацию подавленной экспрессии микроРНК-127 (микроРНК – супрессор опухолей) в раковых клетках мочевого пузыря после лечения лекарственными средствами, модифицирующими хроматин, включая метилирование ДНК и ингибиторы HDAC. Такая терапевтическая активация микроРНК – супрессоров опухолей открывает большие перспективы для поиска новых средств терапии онкологических заболеваний [29][32].
Метод жидкостной биопсии для определения эпигенетических маркеров / Liquid biopsy method for determining epigenetic markers
Учет генетических и эпигенетических изменений у пациентов с онкологическими заболеваниями позволит существенно продвинуться в вопросах улучшения диагностики, прогноза, лечения и реабилитации больных [12]. Ранее характерные эпигенетические биомаркеры определяли непосредственно в опухолевых клетках. Это давало прямую информацию о характере изменений, однако количество биоптата было зачастую недостаточно и не отражало гетерогенность ЗНО.
Недавно появился альтернативный подход к определению эпигенетических биомаркеров, известный как жидкая биопсия. Этот способ позволяет анализировать различные биологические маркеры в жидкостях организма: слюне, крови, бронхоальвеолярном лаваже (БАЛ), спинномозговой жидкости, моче и др. [33]. Указанные образцы можно отобрать в достаточных количествах для анализа. Также данный метод помогает выявить ДНК/РНК/белки, поступающие как из первичной опухоли, так и из метастазов. Это позволяет определить гетерогенность опухоли и ее клональную эволюцию. С помощью жидкой биопсии можно выявить циркулирующую опухолевую ДНК (цДНК), циркулирующую опухолевую РНК, циркулирующие опухолевые клетки и внеклеточные везикулы, которые могут содержать РНК, белки и ДНК.
Клиническая ценность выявленных генетических мутаций в образцах жидкой биопсии (в основном крови) для назначения пациентам таргетной терапии широко известна в медицинском обществе. ЭГИ обнаруживаются на ранних стадиях канцерогенеза, в частности нарушение метилирования ДНК зачастую отмечают в цДНК, что открывает широкие возможности для диагностики рака методом жидкой биопсии [12]. Однако биомаркеры ЭГИ еще далеки от внедрения в реальную врачебную практику в качестве диагностических, прогностических, терапевтических и восстановительных индикаторов. Несмотря на это, на международном рынке уже доступны коммерческие тесты для обнаружения изменений в уровнях метилирования ДНК [34].
Практическое применение эпигенетики в медицине / Practical application of epigenetics in medicine
Постановка диагноза
Своевременная диагностика ЗНО позволит повысить выживаемость пациентов, учитывая, что ранняя верификация патологии увеличивает шансы на хороший терапевтический ответ, восстановление утраченных функций, снижая при этом вероятность метастазирования, рецидива. Так, при выявлении рака яичников на поздней стадии 5-летняя выживаемость достигает всего лишь 30%, а на ранней стадии (опухоль в пределах ткани яичника) – 90% [35].
Рак легких (РЛ) в настоящее время является первым наиболее часто диагностируемым ЗНО и основной причиной смерти от рака во всем мире. В 2022 г. в мире было зарегистрировано 2,4 млн случаев РЛ и 1,8 млн – летальных [36]. Несмотря на существенные успехи в лечении РЛ за несколько последних десятилетий, которые постепенно улучшили проводимую терапию, уровень смертности по-прежнему остается значительным, а 5-летняя выживаемость варьируется в разных странах, но остается стабильно низкой, не превышая 19% [37]. Важными факторами, влияющими на высокую летальность больных РЛ, являются поздняя диагностика и поздняя манифестация заболевания. В последние годы возрос интерес к использованию методов визуализации и биомаркеров для скрининга и раннего выявления патологии. Биологические жидкости, в которых определяют биомаркеры развития РЛ, включают кровь, бронхиальные аспираты, БАЛ, мокроту или плевральный выпот для анализа цДНК, экзосом и циркулирующих опухолевых клеток [12].
Среди биомаркеров метилирования ДНК в диагностике РЛ гиперметилирование гена SHOX2 (англ. short-stature homeobox 2) является наиболее изученным ЭГИ. B. Schimidt et al. показали значимость процесса гиперметилирования SHOX2 в мониторинге состояния пациентов с РЛ на поздних стадиях и больных, получающих необходимую терапию [38]. Другие исследования также подтверждают существенный диагностический потенциал оценки статуса метилирования SHOX2 [39–41].
Отмечают появление коммерчески доступного теста, позволяющего оценивать данный параметр у пациентов с РЛ. EpiProLung® (Epigenomics, Германия) − это тест на основе полимеразной цепной реакции, позволяющий выявить метилирование генов SHOX2 и PTGER4 в образцах крови с достаточно высокими чувствительностью (78%), специфичностью (96%) и площадью под ROC-кривой (англ. area under curve, AUC) 0,73. Эффективность данного теста была показана и на образцах БАЛ [12].
МикроРНК также становятся ценным диагностическим инструментом. X. Chen et al. описали 10 микроРНК (20а, 222, 221, 320, 152, 145, 223, 199а-5p, 24, 25), указывающих на наличие немелкоклеточного РЛ (НМРЛ). Продемонстрированы высокие показатели чувствительности (92,5%), специфичности (90%), AUC (0,97) при использовании указанных микроРНК в комплексе [42].
Обнаружено, что концентрация микроРНК-21 увеличивается в сыворотке и плазме крови у пациентов с НМРЛ, что может стать диагностическим биомаркером ранней стадии данного ЗНО. H. Yu et al. сообщили, что чувствительность использования этого параметра равна 69%, а специфичность − 71,9% [43].
Общей чертой опухолей мочеполовой системы является возможность использования мочи в качестве биологической жидкости для определения циркулирующих опухолевых клеток и цДНК [34]. Среди биомаркеров метилирования ДНК при ЗНО мочеполовой системы гиперметилирование гена глутатион-S-трансферазы Pi (GSTP1) является, безусловно, наиболее часто описываемым ЭГИ, особенно у пациентов с раком простаты [44]. Многие авторы показали более высокую специфичность (около 90%), наблюдаемую при определении данного биомаркера, в сравнении с простатспецифическим антигеном (около 30%) при одинаковой чувствительности в анализе обоих показателей [45][46]. По результатам сопоставления уровней цДНК GSTP1 в образцах мочи и плазмы, анализ мочи имеет большее значение в сравнении с определением данного биомаркера в плазме [47].
Прогнозирование исхода онкологических заболеваний
В отличие от работ, посвященных диагностике заболеваний, исследований, в которых описана связь между метилированием ДНК и ответом на лекарственную терапию РЛ, обнаруженно несколько меньше [48][49].
В клиническом исследовании C. Vinayanuwattikun et al. показана взаимосвязь между гиперметилированием гена SHP1P2 и снижением выживаемости без прогрессирования при распространенном НМРЛ [50]. I. Balgkouranidou et al. выявили, что метилирование ДНК генов SOX17, BMRS1 и DCLK1 существенно ухудшает прогнозы выживаемости пациентов с данным ЗНО [51][52]. Исследование J.L. Ramirez et al. продемонстрировало хороший прогноз выживаемости больных с выявленным метилированием гена SFN [53]. F. Salazar et al. сообщили, что пациенты с неметилированным геном CHFR имели хорошие прогнозы выживаемости при лечении тирозинкиназными ингибиторами рецептора эпидермального фактора роста (англ. epidermal growth factor receptor, EGFR) второй линии [54]. В клиническом исследовании, проведенном H. Wang et al., обнаружено, что повышенные уровни метилированого цДНК генов RASSF1A и APC в плазме крови пациентов наблюдаются в ответ на применяемую химиотерапию. Данные изменения коррелировали с хорошей переносимостью цисплатина [55]. Кроме того, в исследовании B. Schmidt et al. показана взаимосвязь между низким уровнем метилированного гена SHOX2 и большей продолжительностью жизни у больных РЛ [38].
По результатам исследований рака молочной железы, низкий уровень метилированого гена PITX2 в плазме крови соотносится с высокой частотой рецидивов заболевания и низкой выживаемостью пациенток. Также авторы указывают на необходимость учитывать уровень данного биомаркера при назначении антрациклинов [56].
Сопровождающая медикаментозная терапия – неотъемлемая часть любой программы лечения у пациентов онкологического профиля. Эпигенетические маркеры позволят подобрать наиболее эффективную персонифицированную терапию, что, в свою очередь, повышает эффективность реабилитационных мероприятий.
Реабилитация
Реабилитация – это комплекс лечебно-восстановительных мероприятий, имеющих мультидисциплинарный персонифицированный подход и направленных на улучшение как отдельных аспектов, так и общего качества жизни [57]. Особенно актуальна реабилитация у онкологических пациентов, которым целесообразно начать оказывать помощь еще на этапе постановки диагноза до старта лечения (пререабилитация).
Физические упражнения
Одним из новейших направлений физиотерапии и лечебной физической культуры является область эпигенетики, которая изучает, как распространенные факторы окружающей среды, такие как физические упражнения, регулируют экспрессию генов.
Среди значительного количества статей по эпигенетике лишь незначительное число клинических исследований посвящено изучению влияния физических упражнений на эпигеном человека [58]. Крупномасштабные эпидемиологические исследования выявили связь между ЭГИ, опосредованными физическими упражнениями, и долголетием человека [59].
M.D. Nitert et al. в течение 6-месячного исследования влияния тренировок (езда на велосипеде и аэробика) на выносливость выявили метилирование 134 генов в латеральной широкой мышце бедра [60]. M.E. Lindholm et al. показали, что у участников, выполнявших упражнения на одностороннее разгибание колена в течение 3 мес, метилирование ДНК и экспрессия мРНК изменились для более чем 4 тыс. генных локусов в латеральной широкой мышце [61].
Исследования влияния физической нагрузки на ЭГИ преимущественно связаны с анаэробными нагрузками (упражнения высокой интенсивности). При этом лишь небольшое количество работ посвящено изучению изменчивости эпигенома при аэробных нагрузках. Так, J. Denham et al. установили, что режим силовых физических нагрузок в виде 8-недельной программы тренировок с отягощениями вызывали изменения в метилировании ДНК лейкоцитов, в путях, регулирующих анаболические факторы роста, во многих областях генома, включая CpG-островки, гормоны GHRH, FGF1, и в генах, участвующих в реализации иммунного ответа [62].
Регулярная физическая активность существенно снижает вероятность возникновения таких видов ЗНО, как рак молочной железы, рак эндометрия и яичников. Показана значительная роль физических упражнений в улучшении прогноза выживаемости пациентов и снижении частоты возникновения рецидивов онкологических заболеваний. Отмечено, что физическая активность улучшает качество жизни онкологических больных после операции – это проявляется в уменьшении усталости, беспокойства, депрессивных симптомов и облегчении течения некоторых побочных эффектов химиотерапии для больных [63][64]. Наблюдаемые эффекты физической активности могут быть связаны с запуском механизмов ЭГИ, влияющих на течение онкологических заболеваний. Например, доказана взаимосвязь между физической активностью и снижением уровней провоспалительных белков, увеличением концентрации провоспалительных белков.
В свою очередь, регулярные спортивные занятия способствуют метилированию и снижению экспрессии гена, ответственного за синтез белка ASC, обладающего провоспалительной и проапоптотической активностью. Снижение концентрации белка ASC сокращает вероятность возникновения ЗНО [65][66]. Следует отметить, что одни эпигенетические модификации происходят сразу после начала тренировки (например, деметилирование, а следовательно, и активация гена PPAR-γ, экспрессия которого отвечает за ингибирование роста раковых клеток), а другие – лишь через 3 ч после упражнений (например, деметилирование гена PPAR-δ, роль которого в развитии рака еще не выяснена) [67].
В целом регулярные физические упражнения и здоровое питание имеют решающее значение для профилактики рака и его лечения, поскольку оказывают значительное влияние на физиологические процессы организма и могут способствовать общему благополучию онкологических больных.
Питание и нутритивная поддержка
Сбалансированное питание, богатое микро- и макронутриентами, с учетом актуальных потребностей организма и особенностей текущего статуса основной патологии крайне важно для больных онкологического профиля. Недавние исследования показали, что ресвератрол, генистеин, кверцетин, куркумин, изотиоцианаты (сульфорафан в ростках брокколи), полифенолы чая, селен, витаферин А, индол-3-карбинол, являющиеся биоактивными пищевыми компонентами, могут снизить риск развития ЗНО. Это позволяет предположить, что противоопухолевое действие биоактивных пищевых компонентов может затрагивать эпигенетические механизмы [68].
Наиболее изученными при раке фитохимическими веществами являются эпигаллокатехин-галлат (англ. еpigallocatechin gallate, EGCG), кверцетин, ресвератрол, куркумин и сульфорафан. Данные соединения блокируют развитие и прогрессирование опухолей путем воздействия на ключевые сигнальные паттерны, восстанавливая активность генов – супрессоров опухолей и ингибируя экспрессию онкогенов. Эти эффекты частично опосредованы модуляцией эпигенетического механизма, который включает регуляцию активности DNMT и HDAC [69].
EGCG является полифенольным катехином, в основном содержится в зеленом чае и при регулярном употреблении может значительно снизить риск развития рака молочной железы и рака простаты. Известно, что данный катехин индуцирует апоптоз и ингибирует пролиферацию клеток через ЭГИ. V.S. Thakur et al. показали, что EGCG реактивирует белки p21/waf1, Bax и PUMA в клетках рака простаты, приводя к остановке клеточного цикла и апоптозу, опосредованному протеасомной деградацией HDAC1 [70]. В исследовании M.A. Khan et al. выявлено, что EGCG напрямую связывается с ферментативными субстратами DNMT3b и HDAC1, что приводит к их ингибированию и реактивации генов – супрессоров опухолей, в частности ответственных за синтез рецептора ретиноевой кислоты β, кадгерина-1 и ассоциированной с гибелью клеток протеинкиназы-1 [71]. V. Nandakumar et al. продемонстрировали способность EGCG значительно снижать уровни белков DNMT1, DNMT3a и DNMT3b и модулировать активность HDAC, усиливая транскрипцию генов – супрессоров опухолей, ответственных за синтез p16 INK4a и Cip1/p21 в клетках рака кожи. В других исследованиях EGCG индуцировал апоптоз и ингибировал рост клеток ECa109 посредством деметилирования гена P16 при раке пищевода [72][73]. Более того, EGCG реактивировал экспрессию Wnt-ингибирующего фактора-1 (WIF-1) посредством деметилирования промотора и ингибировал рост клеток путем подавления канонического пути Wnt в клеточных линиях рака легких H460 и A549 [74].
Куркумин − полифенол, извлекаемый из корней растения Curcuma longa (куркума длинная) и широко используемый в Китае и Индии в лечебных целях. Некоторые исследования демонстрируют, что куркумин обладает антиоксидантными, противовоспалительными, антипролиферативными, антиангиогенными и противоопухолевыми свойствами. Показана его способность предотвращать метилирование генов – супрессоров опухолей в клетках рака груди in vitro [75]. Отмечена способность куркумина ингибировать экспрессию DNMT1 и восстанавливать активность RASSF1A за счет гипометилирования промотора в эстроген-положительной клеточной линии рака молочной железы MCF-7. Кроме того, куркумин уменьшал пролиферацию клеток и рост опухолей молочной железы in vivo [76]. Куркумин реактивировал ген RARβ (ген – супрессор опухолей) посредством гипометилирования промотора в клетках РЛ H460 [77].
Кверцетин − это флавоноид, который содержится в зеленом чае, красном вине, фруктах и овощах. S. Chirumbolo сообщил о способности кверцетина блокировать клеточный цикл и вызывать проапоптотические изменения в опухолевых клетках, не затрагивая нормальные клетки [78]. X. Xiao et al. показали, что кверцетин может ингибировать связывание трансактиваторов CREB2, C-Jun, C/EBPβ и NF-κB и блокировать рекрутирование коактиватора p300 на промотор COX-2. Кроме того, кверцетин ингибировал активность HAT p300, тем самым ослабляя p300-опосредованное ацетилирование NF-κB. Данные изменения замедляют течение ангиогенеза (одного из элементов развития ЗНО) в эндотелиальных клетках человека [79]. С другой стороны, S. Tan et al. отметили, что кверцетин ингибирует рост опухоли за счет активации p16INK4a, индуцированной деметилированием промотора в клетках колоректального рака [80].
Ресвератрол − это фитоалексин, который содержится во многих растениях, включая чернику, клюкву и виноград. Данный полифенол оказывает химиопрофилактическое и терапевтическое действие при различных типах рака, регулируя биологические функции, такие как пролиферация клеток, деление клеток, апоптоз, ангиогенез и метастазирование опухолей [69][81]. L. Kai et al. [82] в эксперименте на клеточных линиях рака простаты DU145 (мутантный p53) и LNCaP (p53 дикого типа) показали возможность подавлять активность MTA1 с помощью ресвератола. Данные изменения приводили к дестабилизации MTA1/NuRD, корепрессорного комплекса деацетилирования ремоделирования нуклеосом (NuRD), который опосредует посттрансляционные модификации гистонов и негистоновых белков. Указанные изменения приводят к подавлению процесса транскрипции. Подавление регуляции MTA1 приводит к дестабилизации комплекса MTA1/NuRD, что позволяет ацетилировать/активировать p53 [82].
Сульфорафан – это фитохимическое вещество, полученное из овощей семейства крестоцветных. В раковых клетках сульфорафан регулирует клеточный цикл, апоптоз, рост опухоли и прогрессирование опухоли [83]. По данным L. Gao et al., область промотора микроРНК-9-3 гиперметилирована в клетках РЛ, что снижало активность этого гена – супрессора опухоли. Интересно, что сульфорафан восстанавливал экспрессию микроРНК-9-3 посредством эпигенетической регуляции, ослабляя активность DNMT1 и экспрессию белков DNMT3a, HDAC1, HDAC3, HDAC6 и CDH1 [84].
Таким образом, путем определения уровня эпигенетических биомаркеров и выбора подходящих питательных веществ возможно разработать индивидуальную терапевтическую диету для каждого пациента наряду со стандартным лечением опухоли и мерами по предотвращению рецидива.
Другие компоненты реабилитации
Известно, что правильный и полноценный сон может оказать положительное влияние на общее состояние здоровья человеческого организма. Мелатонин, основной гормон эпифиза, участвует в поддержании циркадных ритмов. Обнаружено, что данный гормон обладает противоопухолевыми свойствами, ингибируя рост раковых клеток и образование новых кровеносных сосудов для питания опухоли. Исследования показали, что мелатонин также может изменять метилирование ДНК и микроРНК, усиливая противораковый эффект, в частности при раке молочной железы [85]. Для женщин, прошедших курс лечения гинекологического рака, важно соблюдать правильный режим сна, поскольку выработка мелатонина происходит в ночные часы [86].
Еще одной интересной методикой проведения реабилитации пациентов с ЗНО представляется иглоукалывание (акупунктура), оказывающее влияние на различные эпигенетические процессы. Хроническая боль, которая часто возникает у онкологических больных после лечения, может оказывать множество негативных воздействий на общее состояние здоровья, включая сон, когнитивные функции, настроение, психическое здоровье, сердечно-сосудистую и сексуальную функции. J.H. Jang et al. выявили усиление метилирования ДНК при акупунктуре, что приводило к снижению выраженности невропатической боли после радикальных хирургических вмешательств [87].
Кроме того, социальные и психологические факторы, такие как изоляция, дискриминация и низкий социальный статус, могут отрицательно влиять на эпигеном человека. Стресс и негативные эмоции, испытываемые пациентами онкологического профиля, способны воздействовать на нормальную активность генов. Таким образом, техники релаксации и психологическая поддержка, включая индивидуальную и групповую психотерапию, являются неотъемлемой частью послеоперационной реабилитации и, как научно доказано, способствуют выздоровлению онкологических больных.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Нарушение регуляции эпигенетических процессов является важным фактором в развитии онкологических заболеваний. Достижения в области научных исследований позволили получить ценную информацию об измененных эпигенетических механизмах не только внутри самих аномальных клеток, но и в микроокружении. Эти знания помогают разрабатывать более чувствительные и специфичные методы диагностики ЗНО на ранней стадии с использованием обнаружения эпигенетических биомаркеров в жидких биоптатах. В свою очередь, поисковые исследования новых мишеней для лечения и реабилитации пациентов с онкологическими заболеваниями с учетом данных об ЭГИ дают возможность разработать персонифицированные программы реабилитации.
Эпигенетические процессы наряду с другими факторами, такими как социально-демографические (возраст, раса и т.д.) и клинические (начало заболевания, сопутствующая патология и т.д.), безусловно, влияют на лечебный подход и исход реабилитации больных с ЗНО. Показано, что модуляция эпигенетических процессов оказывает положительное воздействие на реабилитацию онкологических пациентов. Это открыло новые возможности для разработки таргетных препаратов и эффективных планов лечения, учитывающих индивидуальные потребности и особенности больных, для улучшения их качества жизни.
Список литературы
1. Sharma S., Kelly T.K., Jones P.A. Epigenetics in cancer. Carcinogenesis. 2010; 31 (1): 27–36. https://doi.org/10.1093/carcin/bgp220.
2. Lu Y., Chan Y.T., Tan H.Y., et al. Epigenetic regulation in human cancer: the potential role of epi-drug in cancer therapy. Mol Cancer. 2020; 19 (1): 79. https://doi.org/10.1186/s12943-020-01197-3.
3. Sun Y., Sun Y., Yue S, et al. Histone deacetylase inhibitors in cancer therapy. Curr Top Med Chem. 2018; 18 (28): 2420–8. https://doi.org/10.2174/1568026619666181210152115.
4. Tuminello S., Nguyen E., Durmus N., et al. World Trade Center Exposure, DNA Methylation Changes, and Cancer: a review of current evidence. Epigenomes. 2023; 7 (4): 31. https://doi.org/10.3390/epigenomes7040031.
5. Baylin S.B., Jones P.A. Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol. 2016; 8 (9): a019505. https://doi.org/10.1101/cshperspect.a019505.
6. Easwaran H., Tsai H.C., Baylin S.B. Cancer epigenetics: tumor heterogeneity, plasticity of stem-like states, and drug resistance. Mol Cell. 2014; 54 (5): 716–27. https://doi.org/10.1016/j.molcel.2014.05.015.
7. Egger G., Liang G., Aparicio A., Jones P.A. Epigenetics in human disease and prospects for epigenetic therapy. Nature. 2004; 429 (6990): 457–63. https://doi.org/10.1038/nature02625.
8. Солопова А.Г., Блинов Д.В., Демьянов С.В. и др. Эпигенетические аспекты реабилитации онкогинекологических больных. ФАРМА-КОЭКОНОМИКА Современная фармакоэкономика и фармакоэпидемиология. 2022; 15 (2): 294–303. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141.
9. Robertson K.D. DNA methylation and human disease. Nat REV Genet. 2005; 6 (8): 597–610. https://doi.org/10.1038/nrg1655.
10. Jin B., Tao Q., Peng J., et al. DNA methyltransferase 3B (DNMT3B) mutations in ICF syndrome lead to altered epigenetic modifications and aberrant expression of genes regulating development, neurogenesis and immune function. Hum Mol Genet. 2008; 17 (5): 690–709. https://doi.org/10.1093/hmg/ddm341.
11. Mutirangura A. Is global hypomethylation a nidus for molecular pathogenesis of age-related noncommunicable diseases? Epigenomics. 2019; 11 (6): 577–9. https://doi.org/10.2217/epi-2019-0064.
12. Palanca-Ballester C., Rodriguez-Casanova A., Torres S., et al. Cancer epigenetic biomarkers in liquid biopsy for high incidence malignancies. Cancers. 2021; 13 (12): 3016. https://doi.org/10.3390/cancers13123016.
13. Okano M., Bell D.W., Haber D.A., Li E. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell. 1999; 99 (3): 247–57. https://doi.org/10.1016/s0092-8674(00)81656-6.
14. Kim G.D., Ni J., Kelesoglu N., et al. Co-operation and communication between the human maintenance and de novo DNA (cytosine-5) methyltransferases. EMBO J. 2002; 21 (15): 4183–95. https://doi.org/10.1093/emboj/cdf401.
15. Pradhan S., Talbot D., Sha M., et al. Baculovirus-mediated expression and characterization of the full-length murine DNA methyltransferase. Nucleic Acids Res. 1997; 25 (22): 4666–73.
16. Sharma G., Mirza S., Parshad R., et al. Clinical significance of Maspin promoter methylation and loss of its protein expression in invasive ductal breast carcinoma: correlation with VEGF-A and MTA1 expression. Tumour Biol. 2011; 32 (1): 23–32. https://doi.org/10.1007/s13277-010-0087-8.
17. Hattori N., Nishino K., Ko Y.G., et al. Epigenetic control of mouse Oct-4 gene expression in embryonic stem cells and trophoblast stem cells. J Biol Chem. 2004; 279 (17): 17063–9. https://doi.org/10.1074/jbc.M309002200.
18. Kouzarides T. Chromatin modifications and their function. Cell. 2007; 128 (4): 693–705. https://doi.org/10.1016/j.cell.2007.02.005.
19. Bannister A.J., Kouzarides T. Regulation of chromatin by histone modifications. Cell Res. 2011; 21 (3): 381–95. https://doi.org/10.1038/cr.2011.22.
20. Audia J.E., Campbell R.M. Histone modifications and cancer. Cold Spring Harb Perspect Biol. 2016; 8 (4): a019521. https://doi.org/10.1101/cshperspect.a019521.
21. Chen Q.W., Zhu X.Y., Li Y.Y., Meng Z.Q. Epigenetic regulation and cancer (review). Oncol Rep. 2014; 31 (2): 523–32. https://doi.org/10.3892/or.2013.2913.
22. Stronach E.A., Alfraidi A., Rama N., et al. HDAC4-regulated STAT1 activation mediates platinum resistance in ovarian cancer. Cancer Res. 2011; 71 (13): 4412–22. https://doi.org/10.1158/0008-5472.CAN-104111.
23. Li J., Liu C. Coding or noncoding, the converging concepts of RNAs. Front Genet. 2019; 10: 496. https://doi.org/10.3389/fgene.2019.00496.
24. Fabbri M., Garzon R., Cimmino A., et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B. Proc Natl Acad Sci USA. 2007; 104 (40): 15805–10. https://doi.org/10.1073/pnas.0707628104.
25. Friedman J.M., Liang G., Liu C.C., et al. The putative tumor suppressor microRNA-101 modulates the cancer epigenome by repressing the polycomb group protein EZH2. Cancer Res. 2009; 69 (6): 2623–9. https://doi.org/10.1158/0008-5472.CAN-08-3114.
26. Lu J., Getz G., Miska E.A., et al. MicroRNA expression profiles classify human cancers. Nature. 2005; 435 (7043): 834–8. https://doi.org/10.1038/nature03702.
27. Zhang B., Pan X., Cobb G.P., Anderson T.A. MicroRNAs as oncogenes and tumor suppressors. DEV Biol. 2007; 302 (1): 1–12. https://doi.org/10.1016/j.ydbio.2006.08.028.
28. Ventura A., Jacks T. MicroRNAs and cancer: short RNAs go a long way. Cell. 2009; 136 (4): 586–91. https://doi.org/10.1016/j.cell.2009.02.005.
29. Saito Y., Liang G., Egger G., et al. Specific activation of microRNA-127 with downregulation of the proto-oncogene BCL6 by chromatinmodifying drugs in human cancer cells. Cancer Cell. 2006; 9 (6): 435–43. https://doi.org/10.1016/j.ccr.2006.04.020.
30. Kluiver J., Kroesen B.J., Poppema S., van den Berg A. The role of microRNAs in normal hematopoiesis and hematopoietic malignancies. Leukemia. 2006; 20 (11): 1931–6. https://doi.org/10.1038/sj.leu.2404387.
31. Chan J.A., Krichevsky A.M., Kosik K.S. MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells. Cancer Res. 2005; 65 (14): 6029– 33. https://doi.org/10.1158/0008-5472.CAN-05-0137.
32. Saito Y., Jones P.A. Epigenetic activation of tumor suppressor microRNAs in human cancer cells. Cell Cycle. 2006; 5 (19): 2220–2. https://doi.org/10.4161/cc.5.19.3340.
33. Amelio I., Bertolo R., Bove P., et al. Liquid biopsies and cancer omics. Cell Death DISCOV. 2020; 6 (1): 131. https://doi.org/10.1038/s41420020-00373-0.
34. Locke W.J., Guanzon D., Ma C., et al. DNA methylation cancer biomarkers: translation to the clinic. Front Genet. 2019; 10: 1150. https://doi.org/10.3389/fgene.2019.01150.
35. Yang Q., Yang Y., Zhou N., et al. Epigenetics in ovarian cancer: premise, properties, and perspectives. Mol Cancer. 2018; 17 (1): 109. https://doi.org/10.1186/s12943-018-0855-4.
36. Sung H., Ferlay J., Siegel R.L., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021; 71 (3): 209–49. https://doi.org/10.3322/caac.21660.
37. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019; 69 (1): 7–34. https://doi.org/10.3322/caac.21551.
38. Schmidt B., Beyer J., Dietrich D., et al. Quantification of cell-free mSHOX2 plasma DNA for therapy monitoring in advanced stage non-small cell (NSCLC) and small-cell lung cancer (SCLC) patients. PLoS One. 2015; 10 (2): e0118195. https://doi.org/10.1371/journal.pone.0118195.
39. Kneip C., Schmidt B., Seegebarth A., et al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer in plasma. J Thorac Oncol. 2011; 6 (10): 1632–8. https://doi.org/10.1097/JTO.0b013e318220ef9a.
40. Konecny M., Markus J., Waczulikova I., et al. The value of SHOX2 methylation test in peripheral blood samples used for the differential diagnosis of lung cancer and other lung disorders. Neoplasma. 2016; 63 (2): 246–53. https://doi.org/10.4149/210_150419N208.
41. Ilse P., Biesterfeld S., Pomjanski N., et al. SHOX2 DNA methylation is a tumour marker in pleural effusions. Cancer Genomics Proteomics. 2013; 10 (5): 217–23.
42. Chen X., Hu Z., Wang W., et al. Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis. Int J Cancer. 2012; 130 (7): 1620–8. https://doi.org/10.1002/ijc.26177.
43. Yu H., Guan Z., Cuk K., et al. Circulating microRNA biomarkers for lung cancer detection in East Asian populations. Cancers. 2019; 11 (3): 415. https://doi.org/10.3390/cancers11030415.
44. Gurioli G., Martignano F., Salvi S., et al. GSTP1 methylation in cancer: a liquid biopsy biomarker? Clin Chem Lab Med. 2018; 56 (5): 702–17. https://doi.org/10.1515/cclm-2017-0703.
45. Wu T., Giovannucci E., Welge J., et al. Measurement of GSTP1 promoter methylation in body fluids may complement PSA screening: a meta-analysis. Br J Cancer. 2011; 105 (1): 65–73. https://doi.org/10.1038/bjc.2011.143.
46. Porzycki P., Ciszkowicz E. Modern biomarkers in prostate cancer diagnosis. Cent European J Urol. 2020; 73 (3): 300–6. https://doi.org/10.5173/ceju.2020.0067R.
47. Payne S.R., Serth J., Schostak M., et al. DNA methylation biomarkers of prostate cancer: confirmation of candidates and evidence urine is the most sensitive body fluid for non-invasive detection. Prostate. 2009; 69 (12): 1257–69. https://doi.org/10.1002/pros.20967.
48. Constâncio V., Nunes S.P., Henrique R., Jerónimo C. DNA methylationbased testing in liquid biopsies as detection and prognostic biomarkers for the four major cancer types. Cells. 2020; 9 (3): 624. https://doi.org/10.3390/cells9030624.
49. Lissa D., Robles A.I. Methylation analyses in liquid biopsy. Transl Lung Cancer Res. 2016; 5 (5): 492–504. https://doi.org/10.21037/tlcr.2016.10.03.
50. Vinayanuwattikun C., Sriuranpong V., Tanasanvimon S., et al. Epithelial-specific methylation marker: a potential plasma biomarker in advanced non-small cell lung cancer. J Thorac Oncol. 2011; 6 (11): 1818–25. https://doi.org/10.1097/JTO.0b013e318226b46f.
51. Balgkouranidou I., Chimonidou M., Milaki G., et al. Breast cancer metastasis suppressor-1 promoter methylation in cell-free DNA provides prognostic information in non-small cell lung cancer. Br J Cancer. 2014; 110 (8): 2054–62. https://doi.org/10.1038/bjc.2014.104.
52. Balgkouranidou I., Chimonidou M., Milaki G., et al. SOX17 promoter methylation in plasma circulating tumor DNA of patients with non-small cell lung cancer. Clin Chem Lab Med. 2016; 54 (8): 1385–93. https://doi.org/10.1515/cclm-2015-0776.
53. Ramirez J.L., Rosell R., Taron M., et al. 14-3-3sigma methylation in pretreatment serum circulating DNA of cisplatin-plus-gemcitabinetreated advanced non-small-cell lung cancer patients predicts survival: The Spanish Lung Cancer Group. J Clin Oncol. 2005; 23 (36): 9105–12. https://doi.org/10.1200/JCO.2005.02.2905.
54. Salazar F., Molina M.A., Sanchez-Ronco M., et al. First-line therapy and methylation status of CHFR in serum influence outcome to chemotherapy versus EGFR tyrosine kinase inhibitors as second-line therapy in stage IV non-small-cell lung cancer patients. Lung Cancer. 2011; 72 (1): 84–91. https://doi.org/10.1016/j.lungcan.2010.07.008.
55. Wang H., Zhang B., Chen D., et al. Real-time monitoring efficiency and toxicity of chemotherapy in patients with advanced lung cancer. Clin Epigenetics. 2015; 7: 119. https://doi.org/10.1186/s13148-015-0150-9.
56. Absmaier M., Napieralski R., Schuster T., et al. PITX2 DNA-methylation predicts response to anthracycline-based adjuvant chemotherapy in triple-negative breast cancer patients. Int J Oncol. 2018; 52 (3): 755–67. https://doi.org/10.3892/ijo.2018.4241.
57. Нечаев В.С., Магомедова З.А. Медицинская реабилитация: история вопроса и дефиниции. Проблемы социальной гигиены, здравоохранения и истории медицины. 2017; 25 (4): 221–5.
58. Voisin S., Eynon N., Yan X., Bishop D.J. Exercise training and DNA methylation in humans. Acta Physiol. 2015; 213 (1): 39–59. https://doi.org/10.1111/apha.12414.
59. Woelfel J.R., Dudley-Javoroski S., Shields R.K. Precision physical therapy: exercise, the epigenome, and the heritability of environmentally modified traits. Phys Ther. 2018; 98 (11): 946–52. https://doi.org/10.1093/ptj/pzy092.
60. Nitert M.D., Dayeh T., Volkov P., et al. Impact of an exercise intervention on DNA methylation in skeletal muscle from first-degree relatives of patients with type 2 diabetes. Diabetes. 2012; 61 (12): 3322–32. https://doi.org/10.2337/db11-1653.
61. Lindholm M.E., Marabita F., Gomez-Cabrero D., et al. An integrative analysis reveals coordinated reprogramming of the epigenome and the transcriptome in human skeletal muscle after training. Epigenetics. 2014; 9 (12): 1557–69. https://doi.org/10.4161/15592294.2014.982445.
62. Denham J., Marques F.Z., Bruns E.L., et al. Epigenetic changes in leukocytes after 8 weeks of resistance exercise training. Eur J Appl Physiol. 2016; 116 (6): 1245–53. https://doi.org/10.1007/s00421-0163382-2.
63. Cormie P., Atkinson M., Bucci L., et al. Clinical Oncology Society of Australia position statement on exercise in cancer care. Med J Aust. 2018; 209 (4): 184–7. https://doi.org/10.5694/mja18.00199.
64. Schmitz K.H., Campbell A.M., Stuiver M.M., et al. Exercise is medicine in oncology: engaging clinicians to help patients move through cancer. CA Cancer J Clin. 2019; 69 (6): 468–84. https://doi.org/10.3322/caac.21579.
65. Ferioli M., Zauli G., Maiorano P., et al. Role of physical exercise in the regulation of epigenetic mechanisms in inflammation, cancer, neurodegenerative diseases, and aging process. J Cell Physiol. 2019; 234 (9): 14852–64. https://doi.org/10.1002/jcp.28304.
66. Campbell K.L., Winters-Stone K., Wiskemann J., et al. Exercise guidelines for cancer survivors: consensus statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc. 2019; 51 (11): 2375–90. https://doi.org/10.1249/MSS.0000000000002116.
67. Soci U.P.R., Melo S.F.S., Gomes J.L.P., et al. Exercise training and epigenetic regulation: multilevel modification and regulation of gene expression. In: Xiao J. (Ed.) Exercise for cardiovascular disease prevention and treatment: from molecular to clinical. Part 2. Springer; 2017: 281–322. https://doi.org/10.1007/978-981-10-4304-8_16.
68. Özyalçin B., Sanlier N. The effect of diet components on cancer with epigenetic mechanisms. Trend Food Sci Technol. 2020; 102: 138–45. https://doi.org/10.1016/j.tifs.2020.06.004.
69. Carlos-Reyes Á., López-González J.S., Meneses-Flores M., et al. Dietary compounds as epigenetic modulating agents in cancer. Front Genet. 2019; 10: 79. https://doi.org/10.3389/fgene.2019.00079.
70. Thakur V.S., Gupta K., Gupta S. Green tea polyphenols causes cell cycle arrest and apoptosis in prostate cancer cells by suppressing class I histone deacetylases. Carcinogenesis. 2012; 33 (2): 377–84. https://doi.org/10.1093/carcin/bgr277.
71. Khan M.A., Hussain A., Sundaram M.K., et al. (-)-Epigallocatechin-3gallate reverses the expression of various tumor-suppressor genes by inhibiting DNA methyltransferases and histone deacetylases in human cervical cancer cells. Oncol Rep. 2015; 33 (4): 1976–84. https://doi.org/10.3892/or.2015.3802.
72. Nandakumar V., Vaid M., Katiyar S.K. (-)-Epigallocatechin-3-gallate reactivates silenced tumor suppressor genes, Cip1/p21 and p16INK4a, by reducing DNA methylation and increasing histones acetylation in human skin cancer cells. Carcinogenesis. 2011; 32 (4): 537–44. https://doi.org/10.1093/carcin/bgq285.
73. Meng J., Tong Q., Liu X., et al. Epigallocatechin-3-gallate inhibits growth and induces apoptosis in esophageal cancer cells through the demethylation and reactivation of the p16 gene. Oncol Lett. 2017; 14 (1): 1152–6. https://doi.org/10.3892/ol.2017.6248.
74. Gao Z., Xu Z., Hung M.S., et al. Promoter demethylation of WIF-1 by epigallocatechin-3-gallate in lung cancer cells. Anticancer Res. 2009; 29 (6): 2025–30.
75. Kumar U., Sharma U., Rathi G. Reversal of hypermethylation and reactivation of glutathione S-transferase pi 1 gene by curcumin in breast cancer cell line. Tumour Biol. 2017; 39 (2): 1010428317692258. https://doi.org/10.1177/1010428317692258.
76. Du L., Xie Z., Wu L.C., et al. Reactivation of RASSF1A in breast cancer cells by curcumin. Nutr Cancer. 2012; 64 (8): 1228–35. https://doi.org/10.1080/01635581.2012.717682.
77. Jiang A., Wang X., Shan X., et al. Curcumin Reactivates silenced tumor suppressor gene RARβ by reducing DNA methylation. Phytother Res. 2015; 29 (8): 1237–45. https://doi.org/10.1002/ptr.5373.
78. Chirumbolo S. Quercetin in cancer prevention and therapy. Integr Cancer Ther. 2013; 12 (2): 97–102. https://doi.org/10.1177/1534735412448215.
79. Xiao X., Shi D., Liu L., et al. Quercetin suppresses cyclooxygenase-2 expression and angiogenesis through inactivation of P300 signaling. PLoS One. 2011; 6 (8): e22934. https://doi.org/10.1371/journal.pone.0022934.
80. Tan S., Wang C., Lu C., et al. Quercetin is able to demethylate the p16INK4a gene promoter. Chemotherapy. 2009; 55 (1): 6–10. https://doi.org/10.1159/000166383.
81. Berman A.Y., Motechin R.A., Wiesenfeld M.Y., Holz M.K. The therapeutic potential of resveratrol: a review of clinical trials. NPJ Precis Oncol. 2017; 1: 35. https://doi.org/10.1038/s41698-017-0038-6.
82. Kai L., Samuel S.K., Levenson A.S. Resveratrol enhances p53 acetylation and apoptosis in prostate cancer by inhibiting MTA1/ NuRD complex. Int J Cancer. 2010; 126 (7): 1538–48. https://doi.org/10.1002/ijc.24928.
83. Kim J.K., Park S.U. Current potential health benefits of sulforaphane. EXCLI J. 2016; 15: 571–7. https://doi.org/10.17179/excli2016-485.
84. Gao L., Cheng D., Yang J., et al. Sulforaphane epigenetically demethylates the CpG sites of the miR-9-3 promoter and reactivates miR-9-3 expression in human lung cancer A549 cells. J Nutr Biochem. 2018; 56: 109–15. https://doi.org/10.1016/j.jnutbio.2018.01.015.
85. Hardeland R. Melatonin, noncoding RNAs, messenger RNA stability and epigenetics – evidence, hints, gaps and perspectives. Int J Mol Sci. 2014; 15 (10): 18221–52. https://doi.org/10.3390/ijms151018221.
86. Gu C., Yang H., Chang K., et al. Melatonin alleviates progression of uterine endometrial cancer by suppressing estrogen/ubiquitin C/SDHB-mediated succinate accumulation. Cancer Lett. 2020; 476: 34–47. https://doi.org/10.1016/j.canlet.2020.02.009.
87. Jang J.H., Song E.M., Do Y.H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 2021; 162 (2): 514–30. https://doi.org/10.1097/j.pain.0000000000002031.
Об авторах
А. Ю. ВласинаРоссия
Власина Анастасия Юрьевна - к.м.н. WoS ResearcherID: AAF-3130-2020. Scopus Author ID: 1016902.
Ул. Трубецкая, д. 8/2, Москва 119048
Ё. Бегович
Россия
Бегович Ёвана
Ул. Трубецкая, д. 8/2, Москва 119048
Рецензия
Для цитирования:
Власина А.Ю., Бегович Ё. Роль эпигенетики в вопросах диагностики, лечения и реабилитации пациентов со злокачественными новообразованиями. Реабилитология. 2023;1(1):69-79. https://doi.org/10.17749/2949-5873/rehabil.2023.2
For citation:
Vlasina A.Yu., Begovich E. The role of epigenetics in the diagnosis, treatment and rehabilitation of patients with malignant neoplasms. Journal of Medical Rehabilitation. 2023;1(1):69-79. (In Russ.) https://doi.org/10.17749/2949-5873/rehabil.2023.2






